小王同学在厨房中发现一袋白色粉末状的食用物,包装袋上表示的化学成分字迹不清,于是他带到实验室探究其成分。(填空没空1分,计算4分,计10分)
【猜想与假设】猜想1.可能是淀粉 猜想2.可能是纯碱
猜想3.可能是食盐 猜想4.可能是 (俗称小苏打)
【查阅资料】小苏打溶液显碱性,与氯化钡溶液不反应
【实验探究】
| 实验操作 |
实验现象 |
实验结论 |
| (1)取样,溶于适量的水 |
形成无色溶液 |
猜想 不成立 |
| (2)取少量品尝 |
有苦涩味 |
不是 |
| (3)向(1)的溶液中滴加酚酞试液 |
溶液变红 |
是纯碱 |
小华认为,实验(3)结论不准确,原因是 。小华进一步进行了如下实验:取28g 所配溶液与50.2g氯化钡溶液混合,两种物质恰好完全反应。立即出现 ,由此他知道了该白色粉末是何物。过滤,所得滤液质量为58.5g,试计算:
(4)反应后生成的沉淀质量为 克.
(5)所得滤液中溶质的质量分数为多少?
(6分)下图是某试剂瓶标签的部分内容。请回答下列问题:
(1)浓盐酸敞口放置一段时间后会变稀,原因是什么?
(2)配制9%的稀盐酸100 g,需要这种浓盐酸的体积约为多少?(精确到0.1 mL)
(3)某固体氢氧化钠在空气中敞口放置一段时间后部分变质,取该固体10 g,加入质量分数为9%的盐酸至不再产生气泡为止,生成气体的质量为2.2 g,试通过计算说明未变质的氢氧化钠的质量是多少?
小洁同学为测定测定钙片中碳酸钙的含量标注是否属实(50%),她取出4片片剂(每片2.5克),研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40.0 g,称量烧杯中剩余物质量为47.8 g(不含烧杯质量, 假定钙片其它成分不与盐酸反应。)求:
(1) 生成二氧化碳的质量。
(2) 稀盐酸中溶质的质量分数。
(3) 通过计算判断钙片中碳酸钙的含量标注是否属实。
实验室有一瓶未知浓度的BaCl2溶液,某同学取出150g该溶液于烧杯中,向其中逐滴加入溶质质量分数为26.5%的Na2CO3溶液。反应过程中生成沉淀的质量与所用Na2CO3溶液质量的关系如图甲所示。请计算:
(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固体g。
(2)BaCl2溶液的溶质质量分数是多少?(写出计算过程,结果保留到0.1%)
小明同学在某化工厂进行社会实践,技术员与小明一起分析由氯化钙和氯化钠组成的产品中氯化钠的含量。现取13.4g固体样品,全部溶于96. 6g水中,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系。求: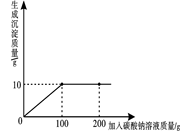
(1)当氯化钙与碳酸钠恰好完全反应时,消耗10.6%的碳酸钠溶液的质量是g。
(2)样品中氯化钠的质量是多少?
(3)当氯化钙与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少?
某品牌补钙剂的主要成分是碳酸钙(杂质不含钙元素),向12g这种补钙剂样品中逐渐加入稀盐酸,盐酸质量和生成气体的质量如下表所示(杂质可溶于水,不和盐酸反应),第三次加入盐酸后,所得溶液中氯化钙的质量分数为20% 。求这份补钙剂含钙的质量分数。
| 第一次 |
第二次 |
第三次 |
|
| 加入稀盐酸的质量 |
18.25g |
36.5g |
47.9g |
| 生成气体的质量 |
2.2g |
4.4g |
4.4g |