将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2.24 L NO,剩余9.6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法中正确的是( )
| A.原混合物中铜和铁各0.15 mol | B.稀硝酸的物质的量浓度为1 mol·L-1 |
| C.第一次剩余9.6 g金属为铜和铁 | D.再加入上述200 mL稀硝酸,还会得到标准状况下2.24 L NO |
用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯当反应达到平衡时,下列说法正确的是
| A.18O只存在于乙酸乙酯中 |
| B.18O存在于水、乙酸、乙醇以及乙酸乙酯中 |
| C.18O存在于乙酸乙酯、乙醇中 |
| D.若与丙酸反应生成的酯的相对分子质量为102 |
我国支持“人文奥运”,坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )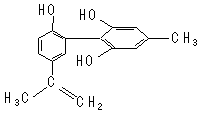
| A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 |
| B.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 |
| C.该分子中的所有原子有可能共平面 |
| D.1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol |
某烃的结构简式为CH3―CH2―CH=C(C2H5)―C≡CH分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数量最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别为 ( )
| A.4、3、5 | B.4、3、6 | C.2、5、4 | D.4、6、4 |
下列实验能够成功的是 ( )
| A.只用溴水一种试剂可鉴别甲苯、己烯、乙醇、四氯化碳四种液体 |
| B.用苯和溴水在Fe催化下可制的溴苯 |
| C.用乙醇、冰醋酸和pH=1的H2SO4溶液混合加热可制备乙酸乙酯 |
| D.用酚酞可鉴别苯酚钠和乙酸钠两种溶液 |
从苯酚的乙醇溶液中回收苯酚的实验中,操作步骤合理的是( )
①蒸馏
②过滤
③静置分液
④加入足量钠
⑤通入足量CO2
⑥加入足量NaOH溶液
⑦加入乙酸和浓硫酸的混合液加热
| A.④⑤③ | B.⑥①⑤③ | C.⑥⑤①② | D.⑦① |