下列有关原电池的说法中,正确的是( )
| A.铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极 |
| B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极 |
| C.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀 |
| D.将反应2Fe3++Fe=3Fe2+设计为原电池,则可用锌片作负极,铁片作正极,FeCl3溶液作电解质 |
按下列实验方案能达到要求的是
| A.用托盘天平称量25.20 g NaCl固体 |
| B.用100 mL量筒量取2.50 mL稀盐酸 |
| C.用酸式滴定管量出11.40 mL 0.1 mol·L--1的盐酸 |
| D.用250 mL容量瓶配制0.1 mol·L--1 150 mL盐酸 |
NA表示阿伏加德罗常数,下列说法正确的是
| A.1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子 |
B.1 mol Al分别放入足量的冷的浓HNO3、稀HNO3 中,反应后转移的电子均为3NA个 中,反应后转移的电子均为3NA个 |
| C.各5.6g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA |
| D.2.7g铝与足量的NaOH溶液反应,转移的电子总数为NA |
下列离子方程式正确的是
| A.硫酸与氢氧化钡溶液反应: Ba2++SO42-=BaSO4↓ |
| B.钠与水反应: 2Na+2H2O=2Na++2OH-+H2↑ |
C.向次氯酸钠溶液中通入足量SO2气体: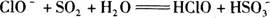 |
| D.Ca(HCO3)2溶液中加入少量NaOH溶液: |
Ca2++2HCO3-+2OH-= CaCO3↓+CO32-+2H2O
已知A、B、C、D均位于前3周期,且 aA2+、bB+、cC3-、dD-核外电子层结构完全相同。则下列有关叙述正确的是
A.原子半径 A>B>D>C B.原子序数d>c>b>a
C.离子半径 C>D>B>A D.单质的还原性 A>B>D>C
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
| A.三者对应的氧化物均为碱性氧化物 |
| B.三者的单质放置在空气中均只生成氧化物 |
| C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu,Fe,Al |