(10分) 氨气是一种重要的化工原料,工业上用N2和H2合成NH3。现已知N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量变化示意图如下左图。回答下列问题:
(1)该反应为 (填“吸热”或“放热”)反应。
(2)合成氨的热化学方程式为 。
(3)若又已知键能数据如上表,结合以上数据求出N-H键键能为 kJ/mol。
(4)工业上,以氨气为原料生产硝酸的第一步为氨催化氧化,请写出该反应的化学方程式 。
现用Na2CO3固体配制500mL 0.200 mol•L-1的Na2CO3溶液。可供选择的仪器有:①玻璃棒;②烧瓶;③烧杯;④胶头滴管;⑤漏斗;⑥天平;⑦药匙。
请回答下列问题:
(1)上述仪器中,在配制Na2CO3溶液时不需要使用的有(填代号),还缺少的仪器是(填仪器名称)。
(2)经计算,需Na2CO3固体质量为。
(3)将所配制的Na2CO3溶液进行测定,发现浓度小于0.200 mol•L-1。请你分析配制过程中可能引起误差偏小的原因。
| A.定容时俯视液面 | B.转移时没有洗涤烧杯和玻璃棒 |
| C.配制时容量瓶没有干燥 | D.定容时仰视液面 |
有A、B、C、D、E、F、G、H等常见物质,已知有如下图转化关系,其中B、C 为常见非金属单质;F为常见金属单质;B在C中燃烧时,火焰呈苍白色;A和D的焰色反应为黄色。G和D溶液混和,产生红褐色沉淀。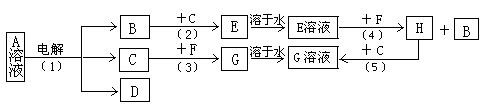
(1)反应(1)中若生成0.1mol B,则转移的电子的物质的量为。写出C与F反应的化学方程式。(注明反应条件)
(2)图中所示的5个反应中属于氧化还原反应的有:。(填写编号)
在 K2Cr2O7 + HCl ="==" KCl + CrCl3 + Cl2+ H2O反应中。
="==" KCl + CrCl3 + Cl2+ H2O反应中。
(1)元素被氧化,是氧化剂。
(2)是氧化产物,发生氧化反应。
(3)在参加反应的盐酸中,起还原剂(被氧化)作用的HCl与起酸性作用的HCl的质量比为。
(4)用双线桥标明电子转移的方向和数目并配平方程式。
有下列物质:①纯净的盐酸;②氯化钠晶体;③熔化的硫酸钠;④纯磷酸晶体;⑤氯气;⑥蔗糖;⑦三氧化硫;⑧钠;⑨氯水;⑩钾钠合金。按下列要求答题:
⑴能导电的物质有:;⑵属于电解质的有。
实验室配制480 mL 0.1 mol·L-1 NaOH溶液,回答下列问题。
(1)应用托盘天平称取氢氧化钠g。
(2)配制NaOH溶液时需用的主要仪器有托盘天平、钥匙、烧杯、玻璃棒、量筒、、。
(3)若实验时遇到下列情况,则所配制的物质的量浓度偏高、偏低还是不变。
①定容时俯视刻度线。②放在滤纸上称量NaOH固体。
(4)请你帮助把试剂瓶(盛放上述配制好的溶液)上标签的内容填上去(标签如下图