某校一研究性学习小组对胆矾晶体受热分解进行讨论。
Ⅰ.他们查阅资料得知:将胆矾晶体置于烘箱中加热时,在79~134℃,晶体失重14.4%;134~250℃,又失重14.4%;250~300℃,再失重7.2%。之后加热至620℃,质量维持不变。小组经过计算得出,胆矾在300~620℃的固体残留物为无水硫酸铜,134℃时的固体残留物的化学式为 。
Ⅱ.小组对无水硫酸铜继续升温加热的可能变化进行猜想。他们提出了产物的以下几种猜想:
①.CuO、SO3;。
②.CuO、SO2和O2;
③.CuO、SO3和SO2;
④.CuO、SO3、SO2和O2
小组经过激烈讨论,认为猜想③不用实验就可排除,他们的理由是
查阅资料:①SO3为无色晶体,熔点16.6℃,沸点44.8℃。
②SO2,熔点:-72.4℃,沸点:-10℃;SO2通入BaCl2溶液中,无明显现象。
Ⅲ.实验探究:
小组按下图所示安装好实验装置。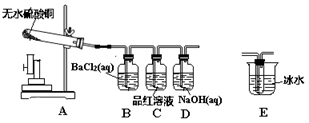
(1)安装好装置后,未装药品前必须进行的操作是 。
D装置的作用是 。
(2)按图示装好药品后,用酒精喷灯对着硬质试管加热。一会儿后,B中溶液产生白色浑浊,C中溶液逐渐褪色。
Ⅳ.实验结果分析:
(1)小组同学大多认为无水硫酸铜热分解产物应该为猜想④。但有一个同学提出质疑,他认为B中溶液产生白色浑浊并不一定能确定产物中含有SO3。他的依据涉及的化学方程式是 。于是,小组同学经讨论决定,再增加一个装置E,你认为该装置应加在 (填装置字母)之间。增加装置后,小组重新实验,证明了产物中确实存在SO3。你认为他们根据什么现象得到这一结论? 。
(2)小组在完成无水硫酸铜热分解的化学方程式时遇到了困难。他们发现该化学方程式为不定方程式,存在无数种配平情况,经过慎密地分析,他们认为只要能确定某些物质的计量数之比,即可确定该化学方程式。如已知SO2与SO3的计量数之比,就能确定该化学方程式。若设SO2与SO3的计量数之比为x,请写出配平后的化学方程式 。
某研究性学习小组研究HNO3的氧化性,设计了如下实验:在盛有新制FeSO4溶液的试管中滴入2滴KSCN溶液,观察现象,然后再滴入几滴浓HNO3,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色快速变为蓝色,并产生红棕色气体,这一奇特现象激起了同学的好奇心与求知欲望,对此现象设计了探究性实验。
(1)甲同学认为是溶液中的Fe2+的干扰造成的,大家经过理性分析,认为可以排除Fe2+的干扰,理由是______________________________________________。
(2)乙同学认为红色消失,说明Fe(SCN)3被破坏,红棕色NO2说明了某些离子与HNO3发生了氧化还原反应,推测可能是KSCN与HNO3作用。KSCN溶液是一种无色液体,根据C、S、N的原子结构和共价键的相关知识推测SCN-中碳原子的杂化轨道类型是_______杂化。
(3)根据乙同学的观点,设计了实验方案1,往浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN,溶液变为浅蓝色,最后变成无色。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种非极性气体;向反应后的溶液中加入BaCl2溶液产生白色沉淀,写出向浓HNO3中滴入KSCN的离子方程式________________________。
(4)丙同学认为SCN-的性质还可进一步探究,设计了方案2,向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均消失变为黄色,而加入碘水时溶液的颜色基本不变。丙同学的设计意图是_________。
(5)通过本次探究,可以得出以下结论:a.用SCN-间接检验Fe2+时应注意__________;b.与SCN-反应使溶液变红的______(填一定或不一定)是Fe3+。
氯化亚砜(SOCl2)为无色或浅黄色发烟液体,易挥发,遇水分解,其制取过程的相关反应如下:
S(s)+Cl2(g)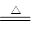 SCl2(l)(Ⅰ)
SCl2(l)(Ⅰ)
SCl2(l)+SO3(l)===SOCl2(l)+ SO2(g)(Ⅱ)
已知二氯化硫(SCl2)熔点-78°C,沸点59°C,下图是实验室由氯气与硫合成二氯化硫的装置。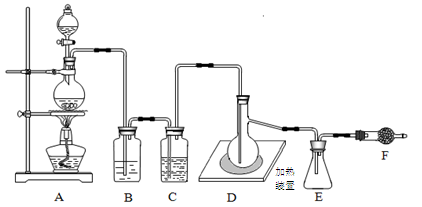
(1)仪器组装完成后,首先进行的一步操作是;反应前要先排尽系统中空气,此做法目的是。
(2)装置B盛放的药品是,装置D中玻璃仪器的名称是,向其中放入一定量的硫粉,加热使之融化,轻轻摇动使硫附着在容器的内壁,形成一薄层膜,这样做的优点是。
(3)实验时,为防止E中液体挥发,可采取的措施是______。装置F(盛放碱石灰)有两个作用:一是吸收多余的氯气,另一个是。
(4)工业上以硫黄、液氯和液体三氧化硫为原料,能生产高纯度(99%以上)氯化亚砜,为使三种原料恰好完全反应,三者的物质的量比为______;氯化亚砜遇水易分解,请设计简单的实验来验证氯化亚砜与水完全反应的产物,简要说明实验操作、现象和结论______。
已知:SOCl2+4NaOH=Na2SO3+2NaCl+2H2O
供选择的试剂:稀盐酸、稀硝酸、氯化钡溶液、硝酸银溶液、品红溶液
可以利用氧化锌粗品(含有Fe2O3、FeO、CuO)为原料制备纯净的氧化锌,其化学工艺流程如下: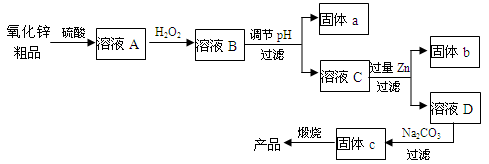
按要求回答下列问题:
(1)加双氧水主要作用是氧化溶液中的Fe2+,该反应的离子方程式为___________。
(2)调节pH主要是使溶液中的Fe3+生成沉淀而被除去,溶液pH对除Fe效率影响如图所示。则除Fe3+时应控制溶液的pH为(填序号)。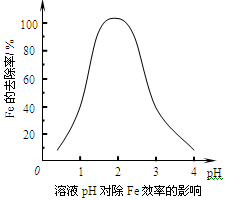
a.3.5~4.0 b.2.5~3.5
c.1.5~2.5 d.0.5~1.5
(3)固体b为_________(填化学式),固体c为碱式碳酸锌,锻烧固体c的化学方程式为__________。
(4)工业上也可以将氧化锌粗品采用碱溶的方法,将氧化锌转化为Na2[Zn(OH)4]溶液,然后电解该溶液制取锌,以石墨为电极电解时,阴极的电极反应式为___________,当生成1mol锌时,阳极上生成气体在标准状况下的体积为__________L。“纸质电池”的纸片内充入的是水和氧化锌组成的电解液,纸的一边镀锌另一边镀二氧化锰,电池总反应为Zn+2MnO2+H2O=ZnO+2MnO(OH),该电池的负极反应式为_________。
某研究性学习小组欲探究FeSO4·7H2O(绿矾)的主要化学性质和用途。
I.FeSO4·7H2O(绿矾)广泛用于医药和工业领域,以下是FeSO4·7H2O的实验室制备流程图:
根据题意回答下列问题:
(1)碳酸钠溶液能除去脂类油污是因为_________________(用必要的文字说明);
(2)废铁屑中含有少量的Fe2O3,在制备过程中无需除去,理由是___________________(用必要的离子方程式说明)。
II.为测定某补血剂(有效成分为FeSO4·7H2O)中铁元素含量,设计实验流程如下,回答下列问题:
(1)步骤①需要用浓硫酸(质量分数为98.3 %)配制100 mL 1 mol·L-1的稀硫酸,所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管及____________;
(2)步骤③所表示的一系列操作依次是:
a.过滤
b.洗涤
c.__________
d.冷却
e.称量
f.重复c~e直至固体质量不变
操作f的目的是_________________________________________________________;
(3)假设实验过程中铁元素无损耗,则每片补血剂含铁元素为________g(用含n的代数式表示)。
III.利用下图装置探究绿矾的热稳定性
(1)实验过程中,观察到③中品红溶液退色,据此推测FeSO4分解过程中最有可能被氧化的元素是___________,请写出④中反应的离子方程式:____________________;
(2)②中有白色沉淀生成,小组成员经过理论分析并结合(1)中的表述推测,绿矾分解的产物最有可能是下列各项中的______________(填序号字母)。
a.Fe2O3、SO3、H2O
b.Fe2O3、SO2、SO3、H2O
c.FeO、SO2、SO3、H2O
二茂铁是一种金属有机化合物,又名双环戊二烯基铁,是由2个环戊二烯负离子和一个二价铁离子键合而成的有机物,它是火箭固体燃烧过程的加速剂、柴油的消烟节能添加剂、汽油抗爆助燃剂;各类重质燃料、煤、原油、聚合物等的消烟促燃剂。由二茂铁合成乙酰基二茂铁的原理如下:
其实验步骤如下:
步骤1:如图Ⅰ所示,取1 g二茂铁与3 mL乙酸酐于装置中,开通搅拌器,慢慢滴加85%磷酸1 mL,加热回流5 min。
步骤2:待反应液冷却后,倒入烧杯中加入10 g碎冰,搅拌至冰全部融化,缓慢滴加NaHCO3溶液中和至中性,置于冰水浴中15 min。抽滤,烘干,得到乙酰基二茂铁粗产品。
步骤3:将乙酰基二茂铁粗产品溶解在苯中,从图Ⅱ装置的分液漏斗中滴下,再用乙醚淋洗。
步骤4:将其中一段时间的淋洗液收集,并进行操作X,得到纯净的乙酰基二茂铁并回收乙醚。
(1)图I中仪器B的名称为,其中磷酸的作用为该实验制备的乙酰基二茂铁分子式为。
(2)步骤2中需缓慢滴加NaHCO3溶液,并且要充分搅拌,原因是。
(3)步骤2中不需要测定溶液的pH就可以判断溶液接近中性,其现象是。
(4)步骤4中操作X的名称是,该操作中不能使用明火的原因是。
(5)为确定产品乙酰基二茂铁中是否含有杂质二乙酰基二茂铁( ),可以使用的仪器分析方法是(写一种即可)。
),可以使用的仪器分析方法是(写一种即可)。