已知;①Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
②Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=b kJ·mol-1。
测得在不同温度下,K值如下:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
(1)反应①为__________(选填“吸热”或“放热”)反应。
(2)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。
(3)下列关于反应①的说法正确的是 。
A.达到平衡后保持其他条件不变,升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B. 在500 ℃下反应,当c(CO2)=c(CO)时,反应达到平衡状态
C.恒温恒容下,当容器内气体密度不再变化时,反应达到平衡状态
D.加压、升温和使用催化剂均可增大反应物的转化率
(4)由已知反应,写出Fe2O3(s)被CO(g)还原成FeO(s)的热化学方程式 。
(5)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)=__________mol·L-1(已知:Ksp[Fe(OH)3]=4.0×10-36)。
(6)新型锌空电池与锂电池相比,具有能量密度高、安全性好且成本低。该电池的总反应为2Zn+O2===2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为_______。
若以该电池为电源,用惰性电极电解硫酸铜溶液,为保证阴极有6.4g铜析出,理论上至少需要标准状况下 L空气(空气中含氧气按20%计算)进入该电池。
(12分)水是组成生命体的重要化学物质,没有水就没有生命。请回答下列问题:
(1)水分子自身作用生成含有相同电子数的阴、阳两种离子,写出此过程的方程式;
(2)25℃时,在由水电离产生的c(H+)=1×10-14 mol·L-1的溶液中
①NH4+、Al3+、Br-、SO42-② Na+、Mg2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3-④K+、Na+、HCO3-、SO42-
四组离子中,一定可以大量共存的是(填序号,下同),可能大量共存的是,一定不能大量共存的是;
(3)在下列反应中,水仅做氧化剂的是(填字母,下同),水既不做氧化剂又不做还原剂的是。
| A.Cl2+H2O=HCl+HClO | B.2Na2O2+2H2O=4NaOH+O2↑ |
| C.CaH2+2H2O=Ca(OH)2+2H2↑ | D.3Fe+4H2O(g) Fe3O4+4H2 Fe3O4+4H2 |
含有少量二价锰盐的溶液,在浓HNO3中与PbO2混合煮沸,溶液呈现紫红色,PbO2转化为Pb(NO3)2,反应中无气体生成,该反应的离子方程式为_____________________,每消耗1mol氧化剂,被氧化的还原剂的物质的量为_______mol。
下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。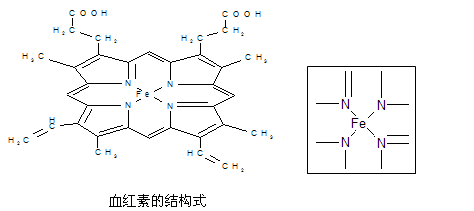
回答下列问题:
⑴血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是,写出基态Fe原子的核外电子排布式。
⑵血红素中N原子的杂化方式为,在右上方的方框内用“→”标出Fe2+的配位键。
⑶铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为,δ、α两种晶胞中铁原子的配位数之比为。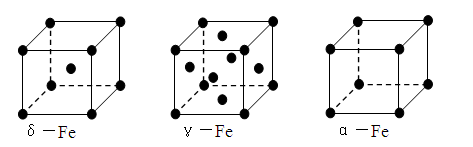
已知:① CH3CH=CHCH2CH3 CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
② R-CH=CH2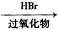 R-CH2-CH2-Br
R-CH2-CH2-Br
香豆素的核心结构是芳香内酯A,A经下列步骤转变为水杨酸。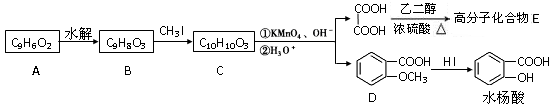
请回答下列问题:
(1)下列有关A、B、C的叙述中不正确的是
a.C中核磁共振氢谱共有8种峰 b.A、B、C均可发生加聚反应
c.1mol A最多能和5mol氢气发生加成反应 d.B能与浓溴水发生取代反应
(2)B分子中有2个含氧官能团,分别为和(填官能团名称),B→C的反应类型为。
(3)在上述转化过程中,反应步骤B→C的目的是。
(4)化合物D有多种同分异构体,其中一类同分异构体是苯的对二取代物,且水解后生成的产物之一能发生银镜反应。请写出其中一种的结构简式:。
(5)写出合成高分子化合物E的化学反应方程式:。
(6)写出以 为原料制备
为原料制备 的合成路线流程图(无机试剂任用),并注明反应条件。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用),并注明反应条件。合成路线流程图示例如下: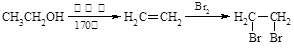
随着工业的迅速发展,产生的废水对水体的污染也日趋严重。通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的方法。下表是常温下金属氢氧化物的Ksp(沉淀溶解平衡常数)和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度;当溶液中金属离子浓度小于10-5 mol•L-1时通常认为该离子沉淀完全)。
| 金属离子 |
Ksp |
pH(10-1 mol•L-1) |
pH(10-5 mol•L-1) |
| Fe3+ |
4.0×10-38 |
2.7 |
3.7 |
| Cr3+ |
6.0×10-31 |
4.3 |
5.6 |
| Cu2+ |
2.2×10-20 |
4.7 |
6.7 |
| Ca2+ |
4.0×10-5 |
12.3 |
14.3 |
(1)某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1 mol•L-1。为除去其中的Fe3+,回收铜,需控制的pH范围是_______________________________。
(2)为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加人适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。
①Cr2O72-转变为Cr3+的离子方程式为______________________。
②pH对废水中Cr2O72-去除率的影响如图。你认为电解过程中溶液的pH取值在______范围内对降低废水中的铬含量最有利,请说明理由:_________________________________。
[注:去除率(%)=[(c0-c)/co]×100%,式中:co—处理前废水中Cr2O72-浓度,c—处理后废水中Cr2O72-的浓度]
(3)沉淀转化在生产中也有重要应用。例如,用Na2CO3溶液可以将锅炉水垢中的CaSO4转化为较疏松而易清除的CaCO3,该沉淀转化达到平衡时,其平衡常数K=_________(写数值)。[已知Ksp (CaSO4)=9.1x10-6,Ksp (CaCO3)=2.8×10-9]