氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解。某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g)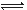 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图I装置制取氨气,可选择的试剂是 。
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中。 当悬浮物较多时,停止制备。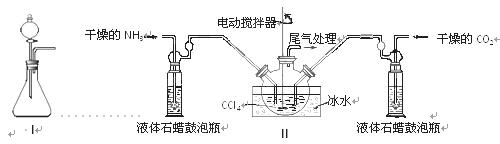
注:CCl4与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是_________________________________________,液体石蜡鼓泡瓶的作用是 。
②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解。 |
得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 |
若溶液不变浑浊,证明固体中不含碳酸铵。 |
| 步骤3:向试管中继续加入 。 |
,证明固体中含有碳酸氢铵。 |
②根据①的结论:取氨基甲酸铵样品3.95 g,用足量氢氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为1.97 g。则样品中氨基甲酸铵的物质的量分数为_______________。[Mr(NH2COONH4)=78、Mr(NH4HCO3) =79、Mr(BaCO3)=197]
柠檬酸亚铁(
)是一种易吸收的高效铁制剂,可由绿矾(
)通过下列反应制备:
下表列出了相关金属离子生成氢氧化物沉淀的
(开始沉淀的
按金属离子浓度为1.0
计算)。
| 金属离子 |
开始沉淀的 | 沉淀完全的 |
|
|
1. 1 |
3. 2 |
|
|
3. 0 |
5. 0 |
|
|
5. 8 |
8. 8 |
(1)制备
时,选用的加料方式是(填字母),原因是。
a.将
溶液与
溶液同时加入到反应容器中
b.将
溶液缓慢加入到盛有
溶液的反应容器中
c.将
溶液缓慢加入到盛有
溶液的反应容器中
(2)生成的
沉淀需经充分洗涤,检验洗涤是否完全的方法是。
(3)将制得的
加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是。②反应结束后,无需过滤,除去过量铁粉的方法是(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是。
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为
、
、
) 出发,先制备绿矾,再合成柠檬酸亚铁。请结合下图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备
晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,,得到
溶液,,得到
晶体。
某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为____________________________________。
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许固体物质于试管中,并向试管中加稀硫酸得溶液B;
②取少量溶液B于试管中,滴加几滴KSCN溶液,结果溶液未变红色,说明硬质试管中固体物质的成分有:____________________________。(填化学式)
(3)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图
所示的操作,可观察到先生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式:
①;
②。
(4)一段时间后,该同学发现(2)中未变红的溶液变成红色,说明Fe2+ 具有性。由此可知,实验室中FeSO4溶液要临时配制并加少量铁粉的原因是。(用离子方程式表示)
下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL的操作,请按要求填空:
(1)所需浓H2SO4的体积为__________(用下一小题的仪器量取)。
(2)如果实验室有15mL、20mL、50mL量筒,应选用_______mL量筒最好。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的烧杯里,并不断搅拌。
(4)将的上述溶液沿玻璃棒注入___________中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要注入上述仪器中,并摇匀。
(5)加水至距刻度线1-2cm时,改用加水,使溶液凹液面跟刻度相平。
(6)用“偏高”“偏低”或“无影响”填空:
① 定容时,观察液面俯视:;
② 摇匀后,液面低于刻度线,没有再加水:;
③ 取浓H2SO4时,倒出浓H2SO4后的量筒中还残留少量液体未处理:。
分析下图装置,回答问题:
(1)装置A的烧瓶中发生的反应的化学方程式为,
(2)装置C的直玻管中发生的反应的化学方程式为,
(3)在装置D的U形管中有无色晶体生成,此晶体的化学式是,
(4)装置E中NaOH的作用是,反应的离子方程式为;
(5)B装置的作用很多,除了可以混匀气体外,
还可以:____________________; __________________________________。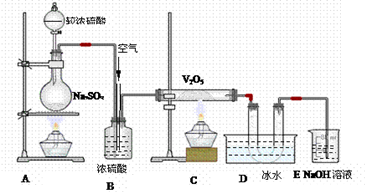
某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。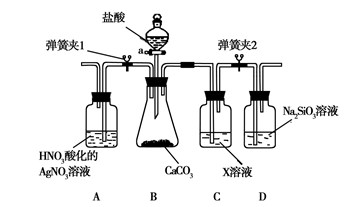
实验操作步骤:
Ⅰ. 打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ. A中看到白色沉淀时,…,关闭活塞a。
请回答:
(1)B中反应的离子方程式是______。
(2)通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
| A.挥发性 | B.还原性 | C.氧化性 | D.酸性 |
(3)C装置的作用是________,X是________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是________,
D中反应的化学方程式是________。
(5)碳、硅的非金属性逐渐减弱的原因是________(从原子结构角度加以解释)。