某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: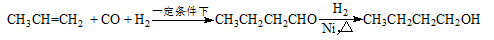
其中CO的制备原理:HCOOH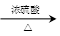 CO↑+H2O,并设计出原料气的制备装置(如下图)
CO↑+H2O,并设计出原料气的制备装置(如下图)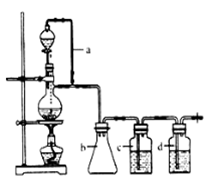
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中可以选择合适的试剂制备氢气、丙烯。写出制备丙烯的化学方程式: 。
(2)若用以上装置制备干燥纯净的CO,装置中a的作用是 ,装置中b的作用是 ,c中盛装的试剂是 。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 (填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和) RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:
RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:
试剂1为 ,操作2为 ,操作3为 。
氧化亚铜是大型水面舰艇防护涂层的重要原料。某小组通过查阅资料,进行如下研究。
I.Cu2O的制取
(1)葡萄糖还原法制Cu2O的化学方程式为。
(2)实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯外,还需要。
II.检验样品中是否含有CuO
方案1:将制得的Cu2O样品溶于足量稀硫酸。
(3)甲同学认为若溶液变为蓝色,则说明样品中含有CuO杂质。乙同学认为此推论不合理,用化学用语解释原因。
(4)甲同学通过反思,认为将定性检验改为定量测定便能确定样品中是否含有CuO杂质,应测量的数据是。
方案2:丙同学认为采用如下装置(所加药品均足量)进行实验,通过测定c装置反应后固体的质量以及d装置反应前后增重的质量,可计算,从而确定样品中是否含有氧化铜。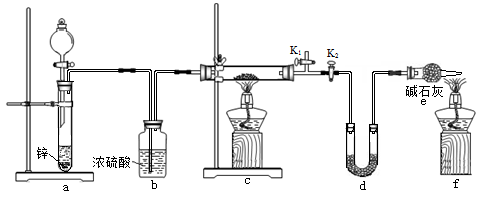
(5)装置a中所加的酸是(填化学式),装置e中碱石灰的作用是。
(6)点燃装置c中酒精灯之前需进行的操作是。
(7)熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是。
铁及其化合物在日常生活中有广泛应用。
(1)写出Fe(OH)2转化为Fe(OH)3的化学方程式。
(2)绿矾(FeSO4·7H2O)是补血剂的原料,易变质。检验绿矾是否变质的试剂是
设计实验检验绿矾是否完全变质
(3)利用绿矾制备还原铁粉的工业流程如下:
①干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O在空气中被氧化为FeOOH,该反应的化学方程式为
②取干燥后的FeCO3样品12.49g ,焙烧,最终得到还原铁粉6.16g,计算样品中杂质FeOOH的质量
(4)以羰基化合物为载体运用化学平衡移动原理分离、提纯某纳米级活性铁粉(含有一些不反应的杂质),反应装置如下图。
Fe(s)+5CO(g)  Fe(CO)5(g) ΔH<0
Fe(CO)5(g) ΔH<0
T1T2(填“>”、“<”或“=”),判断理由是
某合作学习小组的同学拟用硼砂制取硼酸并测定硼酸样品的纯度。制备硼酸的实验流程如下:
(1)溶解硼砂时需要的玻璃仪器有:烧杯和___________。
(2)用pH试纸测定溶液pH的操作方法为__________________________________。
(3)用盐酸酸化硼砂溶液生成硼酸的离子方程式为_________________________。
(4)实验流程中缺少的步骤a、步骤b操作分别为_________、_________。
(5)硼酸酸性太弱不能用碱的标准溶液直接滴定,实验室常采用间接滴定法,其原理为:
滴定步骤为:
①滴定到终点时溶液颜色变化是______________________________________。
②若滴定到终点时消耗NaOH标准溶液22.00mL,则本次滴定测得的硼酸样品中硼酸的质量分数为__________________(假定杂质不反应)。
③若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,将导致测得的结果_____。(选填:“偏大”、“偏小”或“不变”)。
苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯。 它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等。其制备方法为:
已知:
| 名称 |
相对分子质量 |
颜色,状态 |
沸点(℃) |
密度(g·cm-3) |
| 苯甲酸* |
122 |
无色片状晶体 |
249 |
1.2659 |
| 苯甲酸乙酯 |
150 |
无色澄清液体 |
212.6 |
1.05 |
| 乙醇 |
46 |
无色澄清液体 |
78.3 |
0.7893 |
| 环己烷 |
84 |
无色澄清液体 |
80.8 |
0.7318 |
*苯甲酸在100℃会迅速升华。
实验步骤如下:
①在圆底烧瓶中加入12.20 g苯甲酸,25 mL 95%的乙醇(过量),20 mL环己烷以及4 mL浓硫酸,混合均匀并加入沸石,按下图所示装好仪器,控制温度在65~70℃加热回流2 h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性。用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为12.86 mL。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是(填入正确选项前的字母)。
A.25 mLB.50 mLC.100 mL D.250 mL
(2)步骤①中使用分水器不断分离除去水的目的是。
(3)步骤②中应控制馏分的温度在。
A.65~70℃B.78~80℃ C.85~90℃D.215~220℃
(4)步骤③加入Na2CO3的作用是;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是。
(5)关于步骤③中的萃取分液操作叙述正确的是。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为。
由C、Cu、FeCO3、铜锈[主要成分为Cu2(OH)2CO3]组成的固体混合物,进行了如下所示的实验过程:
回答下列问题:
(1)无色气体1的成分是:。
(2)混合物乙中加入NaNO3后,写出一个可能产生无色气体2的反应的离子方程式:。
(3)溶液X中含有的金属阳离子是。
(4)无色气体3成分是,已知固体混合物丁的的质量为5.6g,在标准状况下无色气体3的体积为14.56L,求无色气体3各成分的物质的量:。(写出具体的计算过程)