[化学—选修2:化学与技术]
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到硫酸,如橡胶的硫化、表面活性剂“烷基苯硫酸钠”的合成,铅蓄电池的生产等。工业上生产硫酸的流程图如下:

请回答下列问题
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,已知1g 完全燃烧放出7.2kJ的热量
完全燃烧放出7.2kJ的热量 燃烧反应的热化学方程式_______ ______。
燃烧反应的热化学方程式_______ ______。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用在具有多层催化剂且又热交换的________(填仪器名称)中进行反应。在如图Ⅰ所示的装置中, A处气体进入装置前需净化的原因是 。
(3)精制炉气(含有 体积分数为7%、O2为11%、N2为82%)中
体积分数为7%、O2为11%、N2为82%)中 平衡 转化率与温度及压强关系如图2所示、在实际生产中,
平衡 转化率与温度及压强关系如图2所示、在实际生产中, 催化氧化反应的条件选择常压、
催化氧化反应的条件选择常压、 左右(对应图中A点):而没有选择
左右(对应图中A点):而没有选择 转化率更高的B或C点对应的反应条件,其原因分别是: 、 。
转化率更高的B或C点对应的反应条件,其原因分别是: 、 。
(4)已知:焙烧明矾的化学方程式4KAl(SO4)2•12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O。
焙烧711t明矾(M=474g/mol),若  的利用率为95%,可生产质量分数为98%的硫酸 t。(结果保留小数点后一位)
的利用率为95%,可生产质量分数为98%的硫酸 t。(结果保留小数点后一位)
(5)除硫酸工业外,还有许多工业生产。下列相关的工业生产流程中正确的是
| A.向装置中通入氮气且保持体积不变 |
| B.向装置中通入氧气且保持体积不变 |
| C.添加更多的催化剂 |
| D.降低温度,及时转移SO3 |
(11分)学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3—、Cl—、MnO4—、SO42-等离子中的几种离子。
①经实验可知溶液明显呈酸性。
②取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲,向滤液中加入AgNO3溶液未见沉淀产生。
③另取少量该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当沉淀增加到一定量后开始产生气体丙,最后沉淀完全溶解。
(1)写出气体丙的电子式___________________。
(2)该溶液中一定不含有:___________________(填离子的化学式)离子,一定含有的离子有___________(填离子的化学式)。
(3)在这些不存在的离子中,有一种离子在酸性环境中与SO2反应,试写出该反应的离子方程式:________________________。
(4)请设计实验方案,检验该试液中是否存在可能含有的离子____________________。
(5)为确定上述溶液中所含的各种离子的物质的量,取100mL上述溶液并向其中加入Na2O2固体,产生的沉淀和气体与所加Na2O2固体物质的量的关系曲线如图Ⅰ:该溶液中可能存在的离子的物质的量为________mol。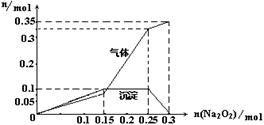
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属, K是一种红棕色气体。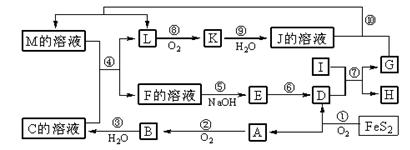
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第__________周期_________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为。
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是。(填写序号)
(4)反应④的离子方程式是:。
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:。
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示。请回答下列问题:
| B |
C |
D |
||
| A |
E |
(1)B、C、D元素的非金属性由大到小的顺序为;(填元素符号)
(2)E的氢化物与其最高价氧化物对应水化物的钾盐共热能发生反应,生成一种气体单质。反应的化学方程式为;
(3)C有多种氧化物,其中甲的相对分子质量最小,在一定条件下2L甲气体与0.5L氧气相混合,若该气体混合物被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是;
(4)在298K下,A、B的单质各1 mol 完全燃烧,分别放出热量aKJ和bKJ,又知一定条件下,A的单质能将B从它的最高价氧化物中置换出来。若此置换反应生成3mol B的单质,则该反应在298K下的△H (注:题中所设单质的为稳定单质)。
(5)要证明与D同主族且相邻的元素的非金属性与E的非金属性强弱,正确、合理的实验操作及现象是。
由中学化学常见元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转换关系,A是由地壳中含量最多的金属元素组成的。请回答:
(1)写出下列物质的化学式:乙、丁、戊。
(2)写出甲物质在工业上的一种主要用途:。
(3)写出甲→乙+丙反应的离子方程式:;
A→乙+C反应的化学方程式:
(6分)(1)Na2O2可用在潜水艇里作为氧气的一种来源,供人们呼吸所需。Na2O2所发生反应的化学方程式为
(2)钠和水反应的化学方程式
(3)铝和氢氧化钠溶液反应的化学方程式