原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍;b和d的A2B型氢化物均为V型分子,c的+1价离子比e的﹣1价离子少8个电子.
回答下列问题:
(1)元素a为,c为;
(2)由这些元素形成的双原子分子为;
(3)由这些元素形成的三原子分子中,分子的空间结构属于直线型的是,非直线型的是(写两种);
(4)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于原子晶体的是,离子晶体的是,金属晶体的是,分子晶体的是;(每空填一种)
(5)元素a和b形成的一种化合物与c和d形成的一种化合物发生的反应常用于防毒面具,该反应的化学方程式为.
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水。实验室以NH4C1、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下: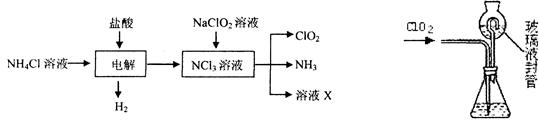
⑴ 写出电解时发生反应的化学方式:。
⑵ 测定ClO2(如右图)的过程如下:在锥形瓶中加入足最的碘化钾,用100 mL水溶解后,再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液。
① ClO2通入锥形瓶与酸性碘化钾溶液反应,反应的离子方程式为:。
② 装置中玻璃液封管的作用是、。
③ 滴定至终点的现象是。
④ 测得ClO2的质量m(ClO2)=。(用含c、V的代数式表示)
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提炼Al2O3并制取铝的流程如下: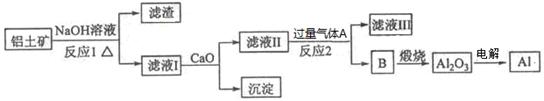
请回答下列问题:
(1)铝与NaOH溶液反应的离子方程式为。
(2)图中涉及分离溶液与沉淀的玻璃仪器有烧杯、玻璃棒、_________。
(3)反应1涉及的化学方程式有、。滤液Ⅰ中加入CaO生成的沉淀是_(填化学式)。
(4)向滤液Ⅱ中通入气体A为,生成沉淀B的离子方程式为。
标准状况,体积相同的四支试管中分别盛满Cl2、NH3、SO2和NO2,分别倒立在盛有足量水的水槽中(假设进入试管的液体不扩散),光照充分溶解。
(1)从物质分类的角度可以推测物质的性质。其中SO2属于_______氧化物(填“酸性”、“碱性”或“两性”)。
SO2+ ( ) → 含氧酸盐。
SO2+ ( ) → 盐 + ( )。
(2)装有NO2的试管倒立在盛有足量水的水槽时,反应的化学方程式为___________________。实验现象为______________________________________________________________________。
(3)装有NH3的试管进行实验时,实验完毕试管内溶液的物质的量浓度为。
(4)装有Cl2的试管倒立在盛有足量水的水槽中经过充分的光照,实验结束试管中剩余的气体是,生成该气体先后发生的化学方程式有、。
(1)在下列反应中:
| A.2F2+2H2O=4HF+O2↑; | B.2Na+2H2O=2NaOH +H2↑; |
C.CaO+H2O=Ca(OH)2; | D.2H2O 2H2↑+O2↑。其中(填序号): 2H2↑+O2↑。其中(填序号): |
①水是氧化剂的是__________,②水是还原剂的是____________,③水既是氧化剂,又是还原剂的是_ __________,④水既不是氧化剂,又不是还原剂的是___________。
(2)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式并用“单线桥法”表示出电子转移的方向和数目:___________________
当化学反应中电子转移的数目为3.01×1023个时,则生成的氯气在标准状况时的体积为L。
三种金属单质A、B、C与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A_____、乙____ ,C的一种氧化物是具有磁性的黑色晶体,该氧化物的化学式是__________。
(2)写出反应②的化学方程式: ____________________。