已知A为一种盐,隔绝空气加热的条件下发生下述变化,C、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、H、L为常见的单质,I为常见的无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。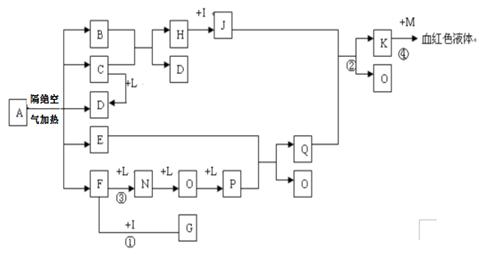
(1)写出G的电子式____________________,M的化学式_________________。
(2)写出反应②的离子反应方程式_________________________________。
(3)写出反应③的化学反应方程式_______________________,反应①—④中属于非氧化还原反应的是_______________。
(4)用石墨电极电解溶液K时,电解初始阶段电极反应方程式为:
阴极:___________________________
阳极:__________________________________
(5)已知A在隔绝空气条件下分解产生的各产物的物质的量之比为
B:C:D:E:F=1:2:2:1:2,写出A分解的化学反应方程式____________________________。
1994年度诺贝尔化学奖授予为研究臭氧做出贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3的分子结构如图,呈V型,两个O----O键的夹角为116.5o。三个原子以一个O原子为中心,另外两个O原子分别构成一个共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键——三个O原子均等地享有这个电子。请回答: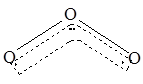
(1)臭氧与氧气的关系是_____________
(2)写出下列分子与O3分子的结构最相似的是_______________
| A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
(3)分子中某原子有一对或几对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有对孤对电子。
(4)O3分子是否为极性分子(填是或否)。
(5)O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:
PbS +O3 ====PbSO4 +O2
生成1mol O2的转移电子物质的量为mol。
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:。在反应体系中加入催化剂,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”),对反应热是否有影响?_______________,原因是_________。
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。根据图二回答下列问题:
① P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式。
② P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2______△H1(填“大于”、“小于”或“等于”),原因是。
写出下列反应的化学反应方程式,并判断其反应类型。
①乙烯与氯化氢反应:,属于反应;
②由苯制取溴苯:,属于反应;
0.1 mol某液态烷烃完全燃烧需要消耗0.8 mol 氧气,写出符合该物质化学式的烷烃的结构简式并写出每种物质系统命名的名称
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为。
(2)B中Sn极的电极反应式为,Sn极附近溶液的pH(填“增大”、“减小”或“不变”)。
(3)C中被腐蚀的金属是,总反应方程式