【改编】(15分)用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:

①A部分还应添加温度控制装置,请你说出一种温度控制方法 ,B部分还应补充什么装置 ;
②C中烧杯中所盛试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),发生该反应的离子方程式为 。
(3)工业也可以用CH3OH与NaClO3为原料在酸性(硫酸酸化)条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+ ="=" 2ClO2↑+Cl2↑+2H2O。
①写出第二步反应的离子方程式 。
②工业生产时需在反应物中加少量Cl-,其作用是 。
③生产中会发生副反应ClO3-+Cl-+H+ ="=" Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为 ,则起始投料时CH3OH与NaClO3的物质的量之比为 。
,则起始投料时CH3OH与NaClO3的物质的量之比为 。
(4)Na2FeO4在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时生产一种无色无味的单质气体,写出Na2FeO4与水反应的离子方程式 ;Na2FeO4可作为一种“绿色多功能”水处理剂的原因是 。
下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅧA |
0 |
|
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 四 |
⑨ |
⑩ |
(1)在这些元素中,最易失电子的元素是,非金属性最强的元素是 ;
(2)化学性质最不活泼的元素是 ,其原子的原子结构示意图为
(3)元素的最高价氧化物对应的水化物中酸性最强的是,呈两性的氢氧化物是。
某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是
Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
(1)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是
;
;
第③步中,生成氢氧化铝的离子方程式是
。
(2)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________。(保留一位小数)
(3)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol 碳单质,转移1mol电子,反应的化学方程式是。
X、Y、Z、E、F为五种短周期元素,原子序数依次递增。X+只含有一个质子;Y的最高正化合价、最低负化合价绝对值相等,在同族元素中其氢化物最稳定;Z的原子核内质子数是Y的最外层电子数的2倍;F与Z同主族;E与X同主族。试推断
(1)下列元素分别是:Y__________、Z____________、F__________。(用元素符号表示)
(2)其中原子半径最大的元素是 ,原子半径最小的元素是 .(填元素符号)
(3)X、Z、E形成化合物的电子式为________,所含有的化学键有________;它属于________化合物(填“离子”或“共价”)。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: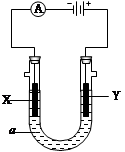
(1)X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为,
在X极附近观察到的现象是。
②Y电极上的电极反应式为,
检验该电极反应产物的方法是。
③总反应的化学方程式。
(2)X、Y都是惰性电极,电解CuSO4溶液,当电路中通过0.4mol 电子时,析出铜的同时在另一个电极可得L O2(标准状况下)
在恒温下,将a mol N2与b mol H2的混合气体通入一个体积为V L固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)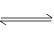 2NH3(g)
2NH3(g)
(1) 若反应进行到某时刻t时,nt(N2)="13" mol,nt(NH3)="6" mol,计算a的值__________。
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量__________。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同)
n(始)∶n(平)= __________。
(4)原混合气体中a∶b=__________。
(5) 达到平衡时,N2和H2的转化率之比α (N2)∶α (H2)= __________。
(6) 若反应达平衡用时为10分钟,用NH3表示从反应开始到平衡的化学反应速率 __________。