【化学-物质结构与性质】
石墨烯(如图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙).

(1)图甲中,1号C与相邻C形成σ键的个数为
(2)图乙中,1号C的杂化方式是
(3)若将图乙所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部,该晶胞中M原子的个数为
(1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3 kJ。写出该反应的热化学方程式 。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气。通入乙烷气体的电极应为 极(填写“正”或“负”),该电极上发生的电极反应是 (填字母代号)。
a. 2C2H6 —14 e- +7O2 ="==" 4CO2 + 6 H2O
b. C2H6 —14 e- + 18 OH- ="==" 2 CO32- + 12 H2O
c. O2 + 2H2O + 4 e- ="==" 4OH-
d. O2— 4 e- + 4H+ ="==" 2H2O
(3)在下图所示实验装置中,石墨棒上的电极反应式为 ;如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。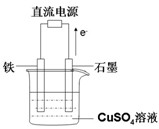
利用从冬青中提取出的有机物A合成抗结肠炎药物Y及其他化学品,合成路线如下图:
根据上述信息回答:
(1)D不与NaHCO3溶液反应,D中官能团的名称是,B→C的反应类型是。
(2)写出上图中A生成B和E的化学反应方程式。下
(3)写出上图中E转化为F的化学方程式。
(4)A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下I和J分别生产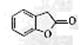 和
和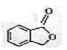 ,鉴别I和J的试剂为。
,鉴别I和J的试剂为。
(5)A的另一种同分异构体K用于合成高分子材料,K可由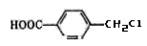 制得,
制得,
写出K在浓硫酸作用下生成的聚合物的结构简式。
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z |
Z和Y同周期,Z的电负性大于Y |
| W |
W的一种核素的质量数为63,中子数为34 |
(1)Y元素位于周期表中区,该元素原子核外共有种不同运动状态的电子。
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键,该分子中中心原子的杂化类型为。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子外围电子排布式是 。
(4)请写出元素W的单质与元素Y的最高价氧化物对应水化物的浓溶液在一定条件下发生反应的化学方程。
(5)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。
已知:
此反应的热化学方程式是 。
下表是A、B、C、D、E五种有机物的有关信息;
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称为;写出在一定条件下,A生成高分子化合物的化学反应方程式。
(2)写出B在浓硫酸作用下,与浓硝酸反应的化学方程式。
(3)C与E反应能生成相对分子质量为100的酯,其化学反应方程式为。
(4)写出由C氧化生成D的化学反应方程式。
现有A、B、C、D四种短周期元素(零族除外),请根据信息回答下列问题。
| 元素 |
A |
B |
C |
D |
| 性质或结构信息 |
元素非金属性较强,其最高价氧化物对应的水化物为强酸,但其单质稳定,常作保护气。 |
原子核外电子占了4个轨道 |
原子半径仅比氢原子大,其氢化物溶于水形成弱酸 |
原子核外有5种不同能量的电子,且s电子数比p电子数少1个 |
(1)A元素原子的核外电子排布式为:。
(2)写出C元素的单质与水反应的化学方程式;A、C两元素的氢化物的稳定性强弱是>(用化学式表示)。
(3)D元素最高价氧化物对应的水化物呈(选填“酸性”、“碱性”或“两性”)。
(4)B元素最简单的氢化物分子为分子(选填“极性”或“非极性”)。4g该氢化物在空气中完全燃烧生成液态水时,放出222.575kJ热量,写出表示该氢化物燃烧热的热化学方程式。