合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的和等气体。铜液吸收的反应是放热反应,其反应方程式为:
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式。
(3)简述铜液吸收及铜液再生的操作步骤(注明吸收和再生的条件)。
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为。其中氮元素原子最外层电子排布的轨道表达式是。通过比较可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知与分子结构相似,的电子式是。熔点高于,其原因是。
下图是常用的实验仪器:(铁架台和玻璃导管、橡皮管、瓶塞等略去)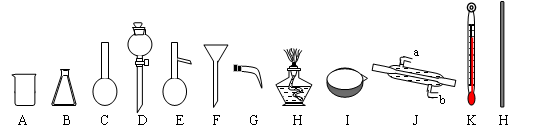
用仪器对应的英文字母及相关文字填空:
(1)填写以下仪器的名称:BDEI
(2)用四氯化碳提取出溴水中Br2单质的方法叫做:。能否用酒精代替四氯化碳进行
实验?原因是:
(3)将Br2的四氯化碳溶液和水分离开的操作叫做:。下列是进行该操作的步骤,正确的
顺序是:
① 将混合物倒入分液漏斗中,并放在铁架台的铁圈上静置、分层;
② 从分液漏斗上口倒出上层水溶液;
③ 将分液漏斗的玻璃塞打开或使玻璃塞上的凹槽对准漏斗颈部的小孔
④ 分液漏斗下面导管紧贴烧杯内壁,旋开活塞,用烧杯接受溶液
⑤ 检查分液漏斗活塞和颈部的玻璃塞是否漏水
(4)已知Br2的沸点是58.5℃,四氯化碳沸点是78℃。将Br2的四氯化碳溶液分离开的方法是,
需要用到的仪器有。连接装置时,仪器J的冷凝水应该进出(填a、b)。
计算
(1)同温同压下的两个相同容器中分别装有O2和O3气体,则两瓶气体中分子数之比
是,原子数之比是,质量之比是,密度之比是
(2)下列所给出的几组物质中:含有分子数最多的是;含有原子数最多的
是;标准状况下体积最大的是。
① 1gH2; ② 2.408×1023个CH4;③ 10.8gH2O; ④ 标准状况下6.72LCO2
(3)设NA表示阿伏加德罗常数,如果ag某气体含有的分子数是b,则cg该气体在
标准状况下的体积是(用含NA的式子表示)。
(4)配制100 mL 1mol/L的的稀H2SO4溶液,需要用量筒量取质量分数为98%的
浓H2SO4(密度为1.84g/cm3)的体积为。
A、B、C、D、E、F是原子序数依次增大的六种常见元素。E的单质在C2中燃烧
的产物可使品红溶液褪色。F和C元素形成的化合物F3C4具有磁性。A的单质在C2中燃烧
可生成AC和AC2两种气体。D的单质是一种金属,该金属在AC2中剧烈燃烧生成黑、白两
种固体。请回答下列问题:
⑴B的单质分子的电子式为;F3C4的化学式为;
F元素在周期表中的位置是_____________。
⑵写出D在AC2剧烈燃烧生成黑白两种固体的化学反应方程式
⑶A、B、C形成的10电子氢化物中,A、B的氢化物沸点较低的是(写化学式)____________;
B、C的氢化物分子结合H+能力较强的是(写化学式)______________,用一个离子
方程式加以证明____________________________。
⑷EC2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体BC,有关反应的离
子方程式为__________________________________________,由此可知BC2和EC2还
原性较强的是(写化学式)______________________________。
A、B、C、D、E是常见的几种粒子,其中A、B为分子,C、E为阳离子,D为阴
离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种粒子反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:A:;B :;C:;D :(2)写出A、B、E三种微粒反应的离子方程式:
海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验
室里从海洋中提取碘的流程如下:
⑴指出提取的过程中有关实验操作名称:①;③;
⑵提取碘的过程中,可供选择的溶剂是__________。
| A.酒精 | B.四氯化碳 | C.乙酸 | D.苯(E)水 |
⑶从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏。指出下图所示实验装置中的错误之处;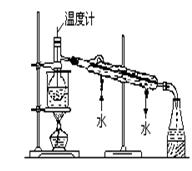
① ; ②;③。
(4)进行上述蒸馏操作时,使用水浴的原因是;最后碘晶在里聚集。