实验室采用、A的混合溶液与过量氨水反应制备,主要流程如下:

(1)为使、同时生成沉淀,应先向沉淀反应器中加入(填""或""),再滴加另一反应物.
(2)如下图所示,过滤操作中的一处错误是.
(3)判断流程中沉淀是否洗净所用的试剂是.高温焙烧时,用于盛放固体的仪器名称是.
(4)无水(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备.
装置中盛放饱和溶液,该装置的主要作用是.中试剂的作用是.用一件仪器装填适当试剂后也可起到和的作用,所装填的试剂为.
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为: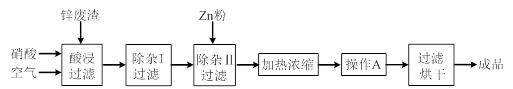
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
4.2 |
5.4 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
6.7 |
8.0 |
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是。
(2)在“除杂I”步骤中,需再加入适量H2O2溶液,目的是将Fe2+氧化为,便于调节溶液的pH使铁元素转化为氢氧化物沉淀除去。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 ~。检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加溶液,若不出现血红色,表明Fe3+沉淀完全。
(3)加入Zn粉的作用是除去溶液中的。
溴被称为“海洋元素”。已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。实验室模拟从海水中提取溴的主要步骤为:
步骤1:将海水蒸发浓缩除去粗盐
步骤2:将除去粗盐后的母液酸化后,通入适量的氯气,使Br-转化为Br2。
步骤3:向步骤2所得水溶液中通入热空气或水蒸气,将溴单质吹入盛有二氧化硫水溶液的容器中
步骤4:再向该容器中通入适量的氯气,使Br-转化为Br2
步骤5:用四氯化碳萃取溴单质,经分液、蒸馏得粗溴。
(1)步骤3中的反应的离子方程式。
(2)步骤2中已经制得了溴,还要进行步骤3和步骤4的原因是溴元素。
(3)步骤5中萃取和分液所需要的主要玻璃仪器为。
(4)可用如图实验装置精制粗溴。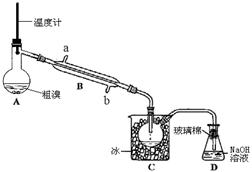
①图中冷却水应从B的口进入(填“a”或“b”) 。
②C中加冰的目的是降温,减少溴的。
为探索工业废料的再利用,某化学兴趣小组设计了如下左图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。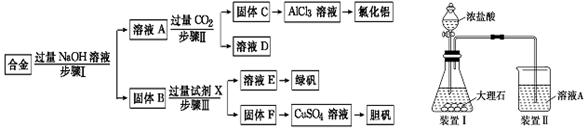
请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是,该操作中除用到烧杯和玻璃棒外,还必须用到的玻璃仪器有。
(2)溶液A中的离子主要有Na+、OH-、;试剂X是。
(3)进行步骤Ⅱ时,该小组用如上右图所示装置及试剂将制得的CO2气体通入溶液A中。一段时间后,
观察到烧杯中产生的白色沉淀逐渐减少,其原因是(用离子方程式表示);为了避免固体C减少,改进的措施是在装置Ⅰ、Ⅱ之间增加一个盛有饱和溶液的洗气瓶。
(4)从溶液E中获得绿矾晶体的实验操作依次为(填操作名称)、冷却结晶、过滤洗涤。
氧化二氯是黄棕色具有强烈刺激性的气体。它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1∶100)同时反应生成次氯酸溶液。制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO·HgCl2)。装置如图,仅铁架台和夹持仪器已略去。
部分物质的有关物理数据如下:
| 化学式 |
熔点(单位:℃) |
沸点(单位:℃) |
| N2 |
-209.86 |
-195.8 |
| O2 |
-218.4 |
-183 |
| CO2 |
-57 |
/ |
| NH3 |
-77.3 |
-33.35 |
| Cl2 |
-101 |
-34.6 |
试回答:
(1)A中深色固体与无色液体制备气体的离子方程式:。
(2)B中盛有液体c是饱和,C中的液体d是浓硫酸。
(3)氧化二氯制备出之后,要冷却为固态才便于操作和贮存,则E中的保温瓶中盛有致冷剂,它应是
(在干冰、冰水、液态空气、液氨中选择)。在E的内管得到的Cl2O中可能含有的主要杂质是反应物中过量的。
(4)装置D、E间的连接方式与A、B、C间的连接方式有明显的区别,这区别是D、E中无管、塞,用这些不同的连接方式的主要理由是氧化二氯接触有机物而。
电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,应考虑回收利用。按如下流程在实验室进行实验:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。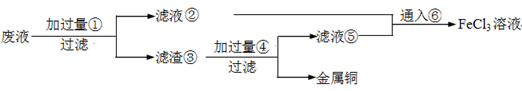
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:。
(2)检验废腐蚀液中含有Fe3+的实验操作是
(3)“过滤”用到的玻璃仪器有:普通漏斗、。
(4)废液中加入过量①后,发生反应的离子方程式:
(5)上述流程中取废液200 mL,其中含CuCl2 1.5 mol·L—1、FeCl2 3.0 mol·L—1、FeCl3 1.0 mol·L—1,若要将铜全部回收,需加入Fe粉的质量应不少于_____________g;将铁的化合物全部转化为FeCl3溶液需通入Cl2的物质的量不少于_______________mol。
(6)某化学兴趣小组利用在下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。
制备Cl2的化学方程式为:
该装置不完整,请在所给虚线框内画出所缺部分,并标注试剂。