甲同学将燃烧的钠迅速伸入到盛有纯净干燥的CO2的集气瓶中,发现金属钠在CO2中继续燃烧,燃烧停止后,在集气瓶底发现有黑色颗粒生成,瓶内壁上有白色物质生成。
(1)甲认为黑色颗粒是 (用化学式填空),白色物质可能是Na2O或Na2CO3;乙同学认为白色物质还有可能是氢氧化钠固体。甲同学认为乙同学的猜想不正确,其理由是 ;
(2)查阅资料发现:氧化钠为白色粉末,溶于水生成氢氧化钠:Na2O+H2O=2NaOH。甲同学据此对白色物质进行了下列实验:
(3)丙同学认为方案1得到的结论不正确,理由是:
(4)钠在二氧化碳中燃烧的化学方式为: ,属于基本反应类型中的 反应。
小明同学所在的学习小组对实验室用过氧化氢溶液制O2的知识做了全方位的探究,下面是他们的学习实录: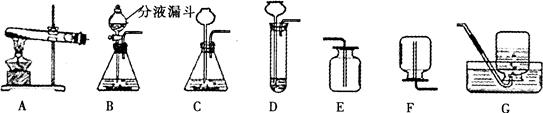
(1)发生装置的探究:根据反应物的状态和反应条件,小明从上列装置中选择了C作为发生装置,你认为他选择的最隹收集装置是____或____。
实验过程中小明发现,锥形瓶中产生了大量气泡,致使反应难以控制.该小组同学认为产生大量气泡是因为________。小聪建议将发生装置改成了B,其理由是_____________。
(2)催化剂选择的探究:通过课堂上的学习,小平了解到:MnO2、土豆块都可以做为H202分解的催化剂,于是萌生了寻找适合催化剂的想法.通过查阅资料,小平还了解到
CuCl2、CuS04等盐溶液也能对过氧化氢的分解起催化作用。对此她做了以下的探究。
①请你帮助她完成实验报告:
| 实验过程 |
实验现象 |
实验结论 |
| 在一支试管中加入4ml 6% H202溶液,然后滴入适量CuCl2溶液,把带火星的木条伸人试管。 |
CuCl2溶液可以催化分解H202 |
|
| 在另一支试管中加入4ml 6% H202溶液,然后滴入适量CuS04溶液,把带火星的木条伸入试管。 |
带火星的木条复燃 |
②已知CuCl2和CuS04在水中可解离出Cu2+和Cl-、SO42-,小组里的同学猜想真正催化分解H202的是CuCl2或CuSO4一溶液中的H2O、Cu2+、Cl-、SO42-某种粒子。你认为最不可能的粒子是_______,理由是__________。
(3)溶质质量分数计算的探究:他们取了3g Mn02加入到锥形瓶中,向分液漏斗中加入50g过氧化氢溶液,待过氧化氢溶液全部滴加完,并经充分反应后,锥形瓶中剩余物质51.4g,请计算产生氧气的质量是多少?所用过氧化氢溶液溶质的质量分数为多少?
实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的化学方程.
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除
、
外,
也可以作
分解的催化剂。
【完成实验】按下表进盈塞坠:羞冽定盆解温度(分解温度越低,催化效果越好)。
| 实验编号 |
实验药品 |
分解温度(
) |
| ① |
580 |
|
| ② |
、
(质量比
) |
350 |
| ③ |
、
(质量比
) |
370 |
| ④ |
、
(质量比
) |
390 |
【分析数据、得出结论】(1)由实验与实验④对比,证明猜想合理
(2)实验所用的三种金属氧化物,催化效果最好的是。
【反思】(1)若要证明
是该反应的催化剂,还要验证它在化学反应前百丽质量和不变;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证.
(3)同种催化剂,还有哪些因素可能影响催化效果,请你再探究 (探究一种因素即可)。.
暖宝宝是一种防寒用品,如图所示。暖宝宝中的主要成分有哪些?发热的原因是什么?
(1)小明探究:暖宝宝中的主要成分是什么?
剪开内包装袋,倒出其中的粉末,发现呈黑色。
【提出猜想】该黑色粉末可能含有炭粉、铁粉、二氧化锰、氧化铜、四氧化
三铁中的一种或几种。
【初步验证】将磁铁靠近黑色粉末,部分被吸引。
【查阅资料】四氧化三铁具有磁性,能被磁铁吸引。
【得出结论】该黑色粉末可能含有。
【进行实验】
| 实验编号 |
实验操作 |
实验现象 |
| ① |
取黑色粉末加足量稀硫酸 |
固体部分溶解,有气泡产生,溶液无蓝色 |
② |
取实验①的残渣灼烧,将内壁涂有 澄清石灰水的小烧杯罩在上方 |
澄清石灰水变浑浊 |
由实验①可知,该黑色粉末肯定含,肯定不含.;写出实验①的化学反应方程式。
由实验②可知,该黑色粉末肯定含。(2)小明思考:暖宝宝为什么会发热?
【查阅资料】暖宝宝中的铁粉在空气中发生了缓慢氧化,进而放出热量。
由此可见,人们可以利用化学反应放出的能量,请再举一例:。(3)人们利用化学反应还可以。
某校科技节的实验比赛中,老师先向大家展示了
三瓶白色粉末,然后取一些
固体于研钵中,接着用一纸板挡住同学们的视线,告诉大家打算继续取
在研钵中混合。过一会儿老师拿开纸板,向同学们展示研钵中的白色粉末。
请设计一个实验方案,判断老师是否取了
于上述研钵中。叙述实验操作、预期现象和结论。
提供的试剂有:稀
、蒸馏水、
溶液、
溶液
| 实验操作 |
预期现象与结论 |
| ,说明老师取了
|
|
| ,说明老师取了
|
氢化钙(
)固体是一种储氢材料,是登山运动员常用的能源提供剂。
【阅读资料】
①碱石灰是氧化钙和氢氧化钠的混合物。
②钙遇水立即发生剧烈反应生成氢氧化钙和氢气。
③氢化钙要密封保存,遇水反应生成氢氧化钙和氢气。
【氢化钙的制备】
氢化钙通常用氢气与钙加热制得。某化学兴趣小组设计的制取装置如图10所示(固定装置省略)。
图10
回答下列问题:
(1)装置A中制取氢气的化学方程式为。
(2)装置B的作用是。
(3)装置C中制取氢化钙的化学方程式为。
(4)若不改变温度,整套装置气密性的检查方法是。
【产品的定量测定】
通过上述方法制得的氢化钙样品中常混有未完全反应的钙(其余可能的杂质忽略不计)。样品纯度的测定步骤如下:
①检查装置气密性,装入药品,按图11(固定装置省略)所示连接仪器。
②调整水准管高度,使量气装置两边的液面保持同一水平。读取液面所在的刻度数据为10.0 mL。
③将Y形管慢慢倾斜,直到A端的水全部与B端的样品混合。
④反应结束,冷却至室温,再次读取液面所在刻度数据为110.0 mL。
回答下列问题:
(5)如何判断样品与水完全反应:。
(6)反应生成氢气的体积为mL。
(7)已知该实验条件下,氢气的密度为0.09 mg/mL。样品中氢化钙的纯度为。(结果精确到0.1%)