设NA为阿伏加德罗常数,下列说法中正确的是
| A.O2和O3的混合气体共6.4g,其中所含氧原子数一定为0.4NA |
| B.将标准状况下22.4LNO与11.2LO2混合后的体积约为22.4L |
| C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA |
| D.标准状况下11.2LCl2溶于1L水中,转移电子的数目为0.5NA |
下列关于能量转换的认识中不正确的是
| A.电解水生成氢气和氧气时,电能转化成化学能 |
| B.煤燃烧时化学能主要转变成热能 |
| C.绿色植物光合作用过程中太阳能转变成化学能 |
| D.白炽灯工作时电能全部转变成光能 |
对于反应N2(g)+3H2(g)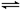 2NH3(g);△H<0,下列研究目的和示意图相符的是
2NH3(g);△H<0,下列研究目的和示意图相符的是
| A |
B |
C |
D |
|
| 目的 |
压强对反应的影响(P2>P1) |
温度对反应的影响 |
平衡体系增加N2对反应的影响 |
催化剂对反应的影响 |
| 图示 |
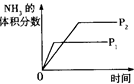 |
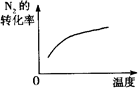 |
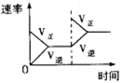 |
 |
已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol;
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol;
③H2(g)+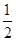 O2(g)===H2O(l)ΔH3=-285.8 kJ/mol。
O2(g)===H2O(l)ΔH3=-285.8 kJ/mol。
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的ΔH为( )
| A.-488.3 kJ/mol |
| B.-244.15 kJ/mol |
| C.+488.3 kJ/mol |
| D.+244.15 kJ/mol |
对可逆反应2A(s)+3B(g)  C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是()
C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是()
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
| A.①② | B.④ | C.③ | D.④⑤ |
在一定温度时,N2与H2反应过程中能量变化的曲线如右图所示。下列叙述正确的是( )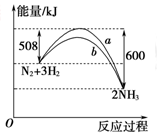
| A.该反应的热化学方程式:N2+3H2 = 2NH3 ΔH=-92 kJ/mol |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应放出的热量增多 |
| D.加入催化剂可增大正反应速率,降低逆反应速率 |