某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa b.C6H5ONa c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥pH=4、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
| A.①②④ | B.①③⑤ | C.③⑤⑥ | D.②④⑥ |
分子式为C4H8O3的有机物,在一定条件下具有下列性质:①在浓硫酸存在下,能分别与CH3CH2OH或CH3COOH反应;②在浓硫酸存在下,能生成一种分子式为C4H6O2的五元环状化合物。根据上述性质,确定C4H8O3的结构简式为
| A.HOCH2COOCH2CH3 | B.CH3CH(OH)CH2COOH |
| C.HOCH2CH2CH2COOH | D.CH3CH2CH(OH)COOH |
合成氨反应:N2 + 3H2 2NH3△H=-92.4 kJ·mol-1下图是该反应的速率—时间图像,一定条件下,t1时建立平衡, t2时改变某一条件,t3时又建立新平衡,t2时改变的条件可能是
2NH3△H=-92.4 kJ·mol-1下图是该反应的速率—时间图像,一定条件下,t1时建立平衡, t2时改变某一条件,t3时又建立新平衡,t2时改变的条件可能是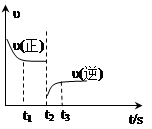
| A.升高温度 | B.分离出部分氨气 |
| C.降低压强 | D.增大反应物浓度 |
工业上或实验室提纯以下物质的方法不合理的是(括号内为杂质)
| A.溴苯(溴):常温下加入稀NaOH溶液,分液 |
| B.MgCl2溶液(Fe3+):加MgO固体,过滤 |
| C.乙酸(水):加新制生石灰,蒸馏 |
| D.硬脂酸(油酸):催化加氢 |
下列离子方程式正确的是
| A.NH4HCO3溶液中加入等物质的量浓度等体积的澄清石灰水HCO3- + OH- + Ca2+ = CaCO3↓ + H2O |
| B.Ca(ClO)2溶液中加入Na2SO3溶液Ca2+ + SO32- = CaSO3↓ |
| C.食醋溶解蛋壳:CaCO3 + 2CH3COOH=Ca2+ + CO2↑ + H2O + 2CH3COO- |
D.将少量CO2气体通入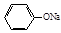 溶液中CO2 + H2O + 2 溶液中CO2 + H2O + 2  2 2 + CO32- + CO32- |
含有等物质的量的CH3COOH和CH3COONa的混合溶液中,下列说法正确的是
| A.c(CH3COOH) + c(H+ )<c(OH-) + c(CH3COO-) |
| B.c(H+ ) + c(CH3COOH) = c(OH-) + c(CH3COO-) |
| C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.c(Na+) = c(CH3COOH) + c(CH3COO-) |