(15分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下: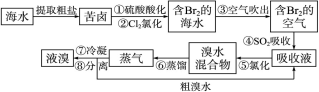
(1)溴在周期表中位于第______周期第________族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是__________________________。
(3)步骤④利用了SO2的还原性,反应的离子方程式为________________________。
(4)步骤⑥的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因____________________________________________________。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是____________。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是_________________________________________。
有一质量为W g相对分子质量为b的某种碱M(OH)2,在一定温度下完全溶解为V mL的饱和溶液,若溶液的密度为ρ g·cm-3,则溶液的物质的量浓度为__________mol·L-1,溶质质量分数为__________,该碱在此温度下的溶解度为_________g。
200 mL 0.2 mol·L-1和100 mL 0.5 mol·L-1的两种盐酸混合,设得到300 mL盐酸,其物质的量浓度是________。若所得盐酸的密度为1.004 g·cm-3,则其溶质的质量分数是____。
用固体NaOH配制100 mL 0.1 mol·L-1的NaOH溶液,在天平上称出_________g NaOH放在烧杯里,用适量的蒸馏水使之完全溶解。把所得的溶液通过___________小心地注入100 mL容量瓶中,然后用蒸馏水______,把每次洗下来的水都注入__________。振荡容量瓶里的溶液,使之混合均匀。缓慢地把蒸馏水注入容量瓶直到______,然后改用_______滴加蒸馏水,使溶液的凹面_________,最后把容量瓶塞塞好,即配制成0.1 mol·L-1的NaOH溶液。在使用容量瓶前,用蒸馏水洗净后_____________,(填“需要”或“不需要”)将容量瓶进行干燥。在配制溶液过程中,两次用到小烧杯,其作用分别是________和_________;两次用到玻璃棒,其作用分别是___________和____________。
如果出现下列情况,会使溶液物质的量浓度如何变化?(填“偏高”“偏低”或“不变”)。
(1)所用NaOH已潮解,则结果________________________________。
(2)向容量瓶中加蒸馏水,未到刻度线,则结果___________________________。
(3)向容量瓶中加蒸馏水,超过刻度线,则结果_______________________________。
(4)小烧杯、玻璃棒没洗涤,则结果________________________________。
(5)观察刻度线时仰视,则结果________________________________。
(6)所用容量瓶中,已有少量蒸馏水,则结果________________________________。
(7)称量的是长期暴露在空气中的NaOH,则结果________________________________。
有下列三组固体混合物:
①Na2O2、NaOH混合物,含Na元素58%
②FeSO4、Fe2(SO4)3混合物,含Fe元素31%
③Na2S、Na2SO3、Na2SO4混合物,含S元素25.6%(以上均为质量分数)
则上述固体混合物中氧元素的质量分数分别是_______、_______、_______。
实验证明铜在低温下不能和O2发生反应,也不能和稀H2SO4共热发生反应,但工业上却是将铜屑倒入热的稀H2SO4中并不断地通入空气来制取CuSO4溶液的。铜屑在此状态下发生的一系列化学反应的方程式为:________________________________________________。利用铜与浓H2SO4在加热条件下也能制备CuSO4溶液,其化学方程式为:___________________________________。以上两种方法前者好还是后者好?原因是什么?