一定条件下,可逆反应X(g) + 3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
| A.c1:c2 = 1:3 | B.平衡时,Y和Z的生成速率之比为3:2 |
| C.X、Y的转化率不相等 | D.c1的取值范围为0 < c1 < 0.14mol/L |
在固态金属氧化物电解池中,高温共电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是
| A.X是电源的负极 |
| B.阴极的反应式是:H2O+2eˉ=H2+O2ˉ |
| C.总反应可表示为:H2O+CO2 = H2+CO+O2 |
| D.阴、阳两极生成的气体的物质的量之比是2︰1 |
在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g) 1/2N2(g)+CO2(g)△H=-373.2KJ/mol,达到平衡后,为提高NO的转化率和该反应的速率,可采取的措施是
1/2N2(g)+CO2(g)△H=-373.2KJ/mol,达到平衡后,为提高NO的转化率和该反应的速率,可采取的措施是
| A.加催化剂同时升高温度 |
| B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 |
| D.降低温度同时增大压强 |
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他电池,电池总反应为V2O5+xLi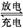 LixV2O5。下列说法合理的是
LixV2O5。下列说法合理的是
| A.电池在放电时,Li+向负极移动 |
| B.锂在放电时作正极,充电时作阳极 |
| C.该电池充电时阳极的反应为LixV2O5 _ xe-=V2O5 + xLi+ |
| D.V2O5只是锂发生反应的载体,不参与电池反应 |
下列实验过程中产生的现象与对应的图形相符的是
A.NaHSO3粉末加入HNO3溶液中  |
B.SO2气体通入H2S溶液中 |
C.NaOH溶液滴入Ca(HCO3)2溶液中 |
D.CO2气体通入NaOH溶液中 |
某氖原子的质量是a g,12C原子的质量是bg用NA表示阿伏加德罗常数,则以下叙述中错误的是
| A.该氖原子的相对原子质量为12a/b |
| B.Wg该氖原子的物质的量为W/aNA mol |
| C.Wg 该氖原子所含的质子数为 10W/a个 |
| D.氖元素的摩尔质量为aNA g/mol |