(14分)2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:①N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1
② H2(g)+
H2(g)+  F2(g) = HF(g) △H = -269kJ·mol-1
F2(g) = HF(g) △H = -269kJ·mol-1
③H2(g)+  O2(g) = H2O(g) △H = -242kJ·mol-1
O2(g) = H2O(g) △H = -242kJ·mol-1
请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g) 2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.200 |
0.100 |
0.080 |
0.050 |
0.050 |
0.050 |
| n(O2)(mol) |
0.100 |
0.050 |
0.040 |
0.025 |
0.025 |
0.025 |
(1)已知:K800℃>K1000℃,则该反应的ΔH ______0(填“大于”或“小于”),用O2表示从0~2 s内该反应的平均速率为__________。
(2)能说明该反应已达到平衡状态的是________。
A.容器内颜色保持不变 B. 2v逆(NO)=v正(O2)
C.容器内压强保持不变 D.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有 。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为 。
(15分)2009年12月18日凤凰网报道,经过北京顶级中西医专家长达7个月的科研攻关,终于制出一种有效治疗甲型H1N1流感的新中药“金花清感方”。其主要成分之一是金银花,而金银花的有效成分之一是绿原酸。下面是有关绿原酸的分子结构及其转化关系,其中E为芳香烃,其苯环上的一氯代物只有一种(部分产物省略)
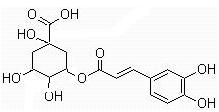
请回答下列问题:
(1)绿原酸的分子式是;A中含氧官能团的名称为;H的结构简式为。
(2)①的反应类型是;1mol绿原酸最多消耗molNaOH。
(3)芳香烃E的同分异构体(与E含有相同的取代基)的沸点由大到小的顺序是(包括E在内)(用结构简式表示)。
(4)写出反应③、④的化学方程式:
③ ;
④ 。
(5)B是咖啡酸,它有多种同分异构体,写出满足下列条件的所有同分异构体的结构简式:(条件:a.苯环上含有两个取代基,且苯环上的一氯代物只有两种;b.能发生水解反应,且产物之一能发生银镜反应;c.能与碳酸氢钠溶液反应)。
一定温度下,向如图所示带有可移动活塞的密闭容器中充入2 L SO2和1 L O2的混合气体,发生如下反应2 SO2 (g) + O2 (g)  2 SO3 (g) 。
2 SO3 (g) 。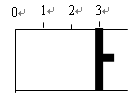
(1)若活塞可自由移动,平衡后,活塞停止在“2.1”处,则该反应中SO2的转化率为________。
(2)若开始时,充入容器的起始物质分别是
①2 L SO2和1 L O2;
②2 L SO3 (g) 和 1 L N2 ;
③1 L SO2、1 L O2和 1 L SO3 (g),
使活塞固定在“3”处,达到平衡后,容器中SO3 (g)占反应混合物的体积分数的大小关系是:
(用序号和“<”、“=”、“>”表示)。
(3)向(1)平衡后的容器中充入0.2 mol 的SO3,活塞移动后再次达到平衡时,测得此过程中从外界共吸收了1.96 kJ 的热量。
写出SO2发生氧化反应的热化学方程式:________。
现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_______p(填“>”“=”“<”)。
(1)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(2)若加入B(保持体系体积不变),则A的转化率_________,B的转化率_________。
(3)若升高温度,则平衡时B、C的浓度之比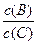 将_________。
将_________。
(4)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______,而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
如下图所示的装置,C、D、E、F都是惰性电极。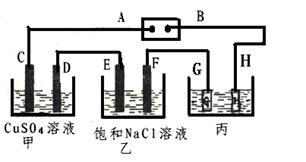
将电源接通后,向乙中滴入酚酞试液.在F极附近显红色。试回答以下问题:
(1)电极A的名称是。
(2)甲装置中电解反应的总化学方程式是 ______________________________。
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56L(标准状况下)气体,电解后溶液体积为500L时,产物的物质的量浓度为__________。
(4)欲用丙装置给铜镀银,G应该是____(填“银”或“铜”),电镀液的主要成分是(填化学式)。
(1)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
①右图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,请在附图中的括号内填入“+”或“—”。
②写出表示丙烷燃烧热的热化学方程式:
___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为_______。
(2)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知: H2O(g)=H2O (l)△H1=-Q1 kJ/mol
C2H5OH(g)=C2H5OH (l)△H2=-Q2 kJ/mol
C2H5OH (g)+3O2(g)=2CO2(g)+3H2O(g)△H3=-Q3 kJ/mol
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为____________kJ。