某高温下,金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验数据记录如下:
| 反应时间t/h |
1 |
4 |
9 |
16 |
25 |
| MgO层厚Y/nm NiO层厚Y'/nm |
0.05a b |
0.2a 2b |
0.45a 3b |
0.80a 4b |
1.25a① 5b② |
①②a和b均为与温度有关的常数。
请回答下列问题:
(1)金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是_______
________________________。
(2)金属氧化膜的膜厚Y跟时间t所呈现的关系是(填“直线”、“抛物线”、“对数”或“双曲线”等类型):MgO氧化膜的膜厚Y属____型;NiO氧化膜的膜厚Y'属____型。
(3)Mg与Ni比较,哪一种金属具有更良好的耐氧化腐蚀性?答:_________,其理由是_____________________________________________________________。
右图中的实验装置可用于制取乙炔.
请填空:
(1)图中,A管的作用是________________________________
____________________________________________________,
制取乙炔的化学方程式是_______________________________
________________________________________________________________________.
(2)乙炔通入KMnO4酸性溶液中观察到的现象是______________________________,乙炔发生了________反应.
(3)乙炔通入溴的CCl4溶液中观察到的现象是______________________________,乙炔发生了________反应.
(4)为了安全,点燃乙炔前应______________________,乙炔燃烧时的实验现象是________________________________________________________________________.
将太阳能有效地转化为电能是化石燃料耗尽后解决世界能源问题的关键.有人提出以降冰片二烯为介质将太阳能转换为电能的方法:首先让降冰片二烯吸收太阳光转化为其同分异构体四环烷,而后四环烷在催化剂的作用下重新转化为降冰片二烯并放出热量,生成的降冰片二烯循环使用.
(1)降冰片二烯的键线式是 ,其分子式为________.
,其分子式为________.
(2)写出降冰片二烯与H2发生加成反应的化学方程式:________________________________________________________________________.
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫.有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.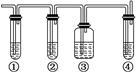
完成下列问题:
(1)图中①、②、③、④装置可盛放的试剂是:
①________;②________;③________;④________.
(将下列有关试剂的序号填入上述空格内)
| A.品红溶液 | B.NaOH溶液 |
| C.浓H2SO4 | D.酸性KMnO4溶液 |
(2)能说明二氧化硫气体存在的现象是__________________________________.
(3)使用装置②的目的是_____________________________________________.
(4)使用装置③的目的是_______________________________________________.
(5)确认含有乙烯的现象是_____________________________________________.
有机化学中有多种同分异构现象,其中有顺反异构,例如2丁烯有两种顺反异构体:A中两个—CH3在双键同侧,称为顺式,B中两个—CH3在双键两侧,称为反式,如下所示: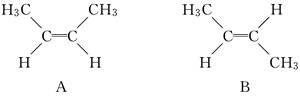
根据此原理,苯丙烯的同分异构体中除有三种位置异构外还有一对顺反异构,写出其结构简式:
(1)三种位置异构:______________,______________,______________;
(2)两种顺反异构: ______________,______________.
乙烯的产量标志着一个国家的石油化工发展水平,它是很重要的工业原料.
(1)已知聚苯乙烯塑料的单体是苯乙烯(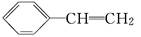 ),由苯乙烯合成聚苯乙烯塑料属于________反应;苯乙烯也能使溴水褪色,其反应的化学方程式为___________________.
),由苯乙烯合成聚苯乙烯塑料属于________反应;苯乙烯也能使溴水褪色,其反应的化学方程式为___________________.
(2)乙烯的某同系物A(化学式为C5H10)和H2加成后的产物的一氯取代物有3种,试写出A可能有的结构简式:___________________________________________________.