钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸和制备氧化铁涂料。 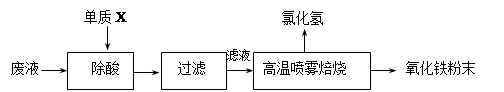
(1)单质X的化学式是 。
(2)氯化亚铁溶液经高温喷雾焙烧转化为HCl气体和氧化铁粉末,有关的化学方程式依次为: 。
(3)某铁红涂料中除含有Fe2O3外,还可能添加有CuO或FeO中的一种,请设计实验方案,探究该铁红涂料中添加物的成分。
① 提出合理假设
假设1:添加了CuO
假设2:添加了FeO
② 请设计方案,验证上述假设,写出实验步骤、预期现象和结论。
限选试剂:铁粉、3mol•L-1H2SO4、0.1 mol•L-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
| 操作步骤 |
预期现象和结论 |
| 步骤1.取少量样品于试管中, ____________________________________________ |
样品全部溶解,得到澄清的溶液。 |
| 步骤2. 步骤3. |
___________________________ ___________________________ |
(4)请计算,用635g水完全吸收“高温喷雾焙烧”产生的HCl气体 升(标准状况),即可得到36.5%的浓盐酸(相对原子质量 Cl 35.5 H 1)。
(8分)在一定温度下,有a. 醋酸 b.硫酸 c.盐酸三种酸:
(1)当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是
用a、b、c表示,下同)
(2) 当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为.反应所需时间的长短关系是______________________.
(3)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是______________________.
(1)常温下物质的量浓度相同的a HF、b NH3·H2O、c H2S溶液,电离常数分别为7.2ⅹ10-4、5.6ⅹ10-10和K1=9.1ⅹ10-8,K2=1.1ⅹ10-12。
①电解质的强弱顺序为_____________(填a、b、c),②氢离子浓度最小的是___(填a、b、c)。
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH反应的中和热的热化学方程式为___________________________。
(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应△H1、△H2、△H3的大小关系为。
(4)已知下列反应的反应热:
①CH3COOH(l) + 2O2 (g)= 2CO2 (g)+ 2H2O(l)△H=-870.3kJ∕mol
②C(S) + O2 (g)= CO2 (g)△H=-393.5kJ∕mol
③2C(S) + 2H2 (g) + O2 (g)= CH3COOH(l)△H=-488.3kJ∕mol
请写出H2燃烧热的热化学方程式。
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
□SiO2+□C+□N2 □Si3N4+□CO
□Si3N4+□CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)若知上述反应为放热反应,则其反应热△H 零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
(4)若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
(5)若已知CO生成速率为v(CO)=18mol/(L.min),则N2消耗速速率为v(N2)= mol/(L.min)。
在一定条件下,可逆反应:mA+nB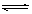 pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是。
(2)A、C是气体,增加B的量,平衡不移动,则B为态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是。
(4)加热后,可使C的质量增加,则正反应是反应(放热或吸热)。
在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:
H2(g)+I2(g)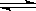 2HI(g)△H <0。改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
2HI(g)△H <0。改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
(1)升高温度;
(2)加入催化剂;
(3)充入更多的H2 ;
(4)扩大容器的体积;
(5)保持容器容积不变,通入氖气。