为测定氯化亚铁和氯化铁的混合物中铁元素的质量分数,某研究小组设计了如下两种实验流程:
(1)操作Ⅱ、Ⅲ是否完全相同?________(填“是”或“否”);操作Ⅳ使用的一种主要硅酸盐材料的仪器名称是________。
(2)甲方案中沉淀A是_______(填化学式);如何判断沉淀A洗涤干净? ________________________________________________________________________。
(3)乙方案中能否用铁粉做还原剂,请用文字说明理由____________________________。
(4)写出乙方案中滴入KMnO4溶液后发生反应的离子方程式_______________________。
(5)若甲方案中红棕色固体质量为bg,乙方案滴定时消耗c mol·L-1 KMnO4溶液dmL,哪个方案测定出来的铁元素含量更准确?_______(填“甲方案”或“乙方案”);据此方案测出的铁元素的质量分数为_______(用字母表示)。
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂。制备硝基苯的过程如下:①配制混酸:组装如下图反应装置。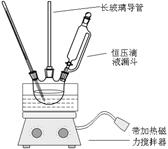
取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中。把18 mL苯加入三颈烧瓶中。
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。
③在50-60℃下发生反应,直至反应结束。
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
已知(1)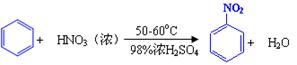

(2)可能用到的有关数据列表如下
| 物质 |
熔点/℃ |
沸点/℃ |
密度(20 ℃) / g·cm-3 |
溶解性 |
| 苯 |
5.5 |
80 |
0.88 |
微溶于水 |
| 硝基苯 |
5.7 |
210.9 |
1.205 |
难溶于水 |
| 1,3-二硝基苯 |
89 |
301 |
1.57 |
微溶于水 |
| 浓硝酸 |
 |
83 |
1.4 |
易溶于水 |
| 浓硫酸 |
 |
338 |
1.84 |
易溶于水 |
请回答下列问题:
(1)配置混酸应先在烧杯中先加入。
(2)恒压滴液漏斗的优点是。
(3)实验装置中长玻璃管可用代替(填仪器名称)。
(4)反应结束后产品在液体的层(填“上”或者“下”),分离混酸和产品的操作方法为。
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?。
(6)为了得到更纯净的硝基苯,还须先向液体中加入除去水,然后蒸馏,
无水硫酸铜受热分解生成氧化铜和气体,受热温度不同生成的气体成分也不同。气体成分可能含SO3、SO2和O2中的一种、两种或三种。某化学课外活动小组设计探究性实验,测定反应产生的SO3、SO2和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示:
【提出猜想】
猜想I.硫酸铜受热分解所得气体的成分可能只含SO3一种;
猜想Ⅱ.硫酸铜受热分解所得气体的成分可能只含_______两种。
猜想Ⅲ.硫酸铜受热分解所得气体的成分可能含有_______三种。
【实验探究】
已知实验结束时,硫酸铜完全分解。
(1)组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为①→⑨→⑩→⑥→⑤→____→_____→_____→______→②。(填接口序号)
(2)若实验结束时装置B中量筒没有收集到水,则证明猜想_______(填“I”“Ⅱ”或“Ⅲ’’)正确。
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后,测得相关数据也不
同,数据如下:
请通过计算,推断出在第一小组和第二小组的实验条件下CuSO4分解的化学方程式:
第一小组:_____________________________________________________________;
第二小组:_____________________________________________________________。
实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:
| 实验编号 |
待测盐酸的体积(mL) |
NaOH溶液的浓度(mol·L-1) |
滴定完成时,NaOH溶液滴入的体积(mL) |
| 1 |
20.00 |
0.10 |
24.18 |
| 2 |
20.00 |
0.10 |
23.06 |
| 3 |
20.00 |
0.10 |
22.96 |
(1)滴定达到终点的标志是。
(2)根据上述数据,可计算出该盐酸的浓度约为(保留小数点后叁位)。
(3)若滴定结束时,碱式滴定管中的液面如图所示,终点读数为mL。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(1)容量瓶上含有下列量中的(填写字母)
A、压强 B、温度 C、容积 D、密度 E、刻度线
(2)用浓硫酸配制250mL2mol∙L-1硫酸溶液时,所需的玻璃仪器除烧杯、玻璃棒和胶头滴管之外,还需要(填仪器名称);在下列配制过程示意图中,有错误的是(填写序号)。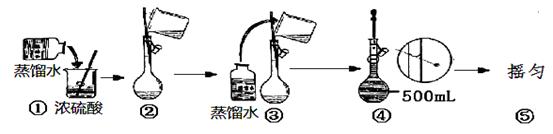
(3)现要用容量瓶配制500mL0.4mol∙L-1Na2CO3溶液,配好的溶液倒入试剂瓶后需要贴上标签。请你帮助把下图标签上的内容填上去。
(4)下列情况将使配制溶液的物质的量浓度偏低的有(填序号)
A.容量瓶用蒸馏水洗净后,未待干燥便用来配制
B.NaOH溶解后趁热移入容量瓶中
C.定容时,俯视刻度线
D.摇匀后发现液面未到刻度线,继续加水至刻度线
某化学小组为测定加碘盐中KIO3的质量分数,进行了如下实验。
已知:KIO3 + 5KI + 3H2SO4= 3K2SO4 + 3I2 + 3H2O
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
步骤一:准确称取a g加碘盐,配制成250mL溶液;
步骤二:取所配制溶液25.00mL于锥形瓶中,加稀硫酸酸化,再加入足量的KI溶液;
步骤三:用bmol·L-1 Na2S2O3溶液的溶液滴定步骤二所得溶液至终点,记录数据;再重复滴定2次,平均消耗Na2S2O3溶液的体积为12.00mL。
(1)步骤一中配制250mL溶液,所用到的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还有。
(2)步骤三中进行滴定的过程中下列哪个操作正确,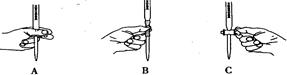
选择作为指示剂,到达滴定终点时的现象为。
(3)实验测得此加碘盐中KIO3的质量分数=(KIO3的相对分子质量为214)。