下列化学原理的应用,主要是利用沉淀溶解平衡原理来解释的是( )
①灰粪共用损肥分;②使用含氟牙膏能生成更难溶且耐酸的氟磷酸钙对牙齿起到更好的保护作用
③溶洞、珊瑚的形成;④水垢中Mg(OH)2的形成;⑤误将钡盐[BaCl2、Ba(NO3)2]当做食盐食用后,常用0.5%的Na2SO4溶液解毒;
| A.① ② ③ ④ | B.② ③ ⑤ | C.② ③ ④ ⑤ | D.全部 |
下列离子方程式正确的是
| A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液,至沉淀完全: 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| B.碳酸钠与醋酸溶液反应:CO32-+2CH3COOH=CO2↑+2CH3COO- +H2O |
| C.将1~2mL氯化铁饱和溶液加入到20 mL沸水中: Fe3++3H2O 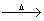 Fe(OH)3(胶体)+3H+ Fe(OH)3(胶体)+3H+ |
| D.氢氧化铁与氢碘酸中和:Fe(OH)3+3H+=Fe3++3H2O |
下列离子方程式正确的是
| A.AlCl3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+; |
B.C6H5ONa溶液中通入少量CO2:2C6H5O-+CO2+H2O 2C6H5OH+ CO32-; 2C6H5OH+ CO32-; |
| C.FeBr2溶液中通入少量Cl2:2Br-+Cl2=Br2+2Cl-; |
| D.Mg(HCO3)2溶液中加入足量NaOH溶液: |
Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O.
下列各组离子,能够在溶液中大量共存的是:
| A.Na+、Al3+、NO3-、AlO2- | B.Na+、Ca2+、HCO3-、HSO4- |
| C.Cu2+、K+、NO3-、OH- | D.S2O32-、Na+、H+、SO42- |
E.Fe3+、Cl-、SCN-、K+ F.Fe3+、NH4+、Cl-、NO3-
G.Fe2+、Cl-、NO3-、H+ H.Na+、Al3+、SO42-、HCO3-
在pH=1的无色透明溶液中,不能大量共存的离子组是:
| A.Al3+、Ag+、NO3-、I- | B.Mg2+、NH4+、NO3-、Cl- |
| C.NH4+、K+、S2-、Br- | D.Zn2+、Na+、NO3-、SO42- |
下列说法正确的是(NA表示阿伏加德罗常数)
| A.标准状况下,以任意比例混合的甲烷和丙烷混合物22.4L,则所含有的分子数为NA |
B.标准状况下,1L辛烷完全燃烧后,所生成气态产物的分子数为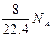 |
| C.常温常压下,活泼金属从盐酸中置换出1molH2时发生转移的电子数为2NA |
| D.常温常压下,1mol氦气含有的核外电子数为4NA |