下列离子方程式正确的是
| A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液,至沉淀完全: 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| B.碳酸钠与醋酸溶液反应:CO32-+2CH3COOH=CO2↑+2CH3COO- +H2O |
| C.将1~2mL氯化铁饱和溶液加入到20 mL沸水中: Fe3++3H2O  Fe(OH)3(胶体)+3H+ Fe(OH)3(胶体)+3H+ |
| D.氢氧化铁与氢碘酸中和:Fe(OH)3+3H+=Fe3++3H2O |
下列物质间的反应,其能量变化符合如图的是( )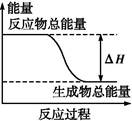
| A.铁与硫粉在加热条件下的反应 |
| B.灼热的碳与二氧化碳反应 |
| C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合 |
| D.碳酸钙的分解 |
小明做实验时不小心粘了一些高锰酸钾,皮肤上出现了难看的黑斑,老师告诉他可以用草酸的稀溶液进行清洗,其反应的离子方程式为:
MnO4—+H2C2O4+H+—— CO2↑+Mn2++ (未配平),下列说法中正确的是 (填字母)。
| A.该反应的氧化剂为H2C2O4 |
| B.该反应右边横线上的产物为OH- |
| C.该反应配平后H+的化学计量数为6 |
| D.在该反应中有1 mol H2C2O4参加反应,转移电子总数为6NA |
NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2的反应方程是:MnO4—+NO2—+  Mn2++NO3—+H2O(未配平)。下列叙述中正确的是( )
Mn2++NO3—+H2O(未配平)。下列叙述中正确的是( )
| A.该反应中NO2—被还原 |
| B.反应过程中溶液的pH减小 |
| C.生成1 mol NaNO3需消耗0.4 mol KMnO4 |
| D.中的粒子是OH- |
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体。它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O 2NO+HNO3+9HF,下列有关说法正确的是( )
2NO+HNO3+9HF,下列有关说法正确的是( )
| A.反应中NF3是氧化剂,H2O是还原剂 |
| B.反应中被氧化与被还原的原子物质的量之比为2∶1 |
| C.若反应中生成0.2 mol HNO3,则反应共转移0.2 mol e- |
| D.NF3在潮湿的空气中泄漏会产生白雾、红棕色气体等现象 |
下列有关说法正确的是( )
| A.1 mol Cl2参加反应转移电子数一定为2NA |
B.在反应KIO3+6HI KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA |
C.根据反应中HNO3(稀) NO,而HNO3(浓) NO,而HNO3(浓) NO2可知,氧化性HNO3(稀)>HNO3(浓) NO2可知,氧化性HNO3(稀)>HNO3(浓) |
| D.含有大量NO3—的溶液中,不能同时大量存在H+、Fe2+、Cl- |