化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是 (写化学式)
(2)“三酸”与“两碱”之间均可反应,若用化学方程式表示有六个(酸过量时),若用离子方程式表示却只有两个,请写出这两个离子方程式(酸过量时)
、 。
(3)烧碱、纯碱均可吸收CO2,当含0.1molNaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况。按吸收CO2由少到多的顺序,四种固体组成的化学式分别是: , , , 。
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
N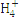 |
S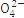 |
N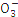 |
Cl- |
| 浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH= 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+ O2(g) H2O(g)ΔH="-241.8" kJ·mol-1①
O2(g) H2O(g)ΔH="-241.8" kJ·mol-1①
C(s)+ O2(g) CO(g) ΔH="-110.5" kJ·mol-1②
O2(g) CO(g) ΔH="-110.5" kJ·mol-1②
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:
N2(g)+O2(g) 2NO(g) ΔH>0
2NO(g) ΔH>0
若1 mol空气含0.8 mol N2和0.2 mol O2,1 300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g) 2C(s)+O2(g)
已知该反应的ΔH>0,简述该设想能否实现的依据:
。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
将标准状态下体积为0.224L的某气态烃完全燃烧,保持温度为120℃,将燃烧产物依次通过浓硫酸和足量澄清石灰水,测得浓硫酸增重0.36g,生成白色沉淀质量为2g。求该气态烃的结构简式。
火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:。
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol•L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是。
③ 某研究小组为探究提高含硫烟气中SO2的
吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则:,
有利于提高SO2的吸收效率。
(3)工厂仓库存放的Na2SO3药品已部分被空气
氧化,该化学小组想用已知浓度的酸性KMnO4
溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式___________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是_(填字母)。




A B C D E
④ 滴定结果如下表所示:
| 滴定次数 |
待测溶液 的体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
2.20 |
20.20 |
则该药品中Na2SO3的质量分数为_________。
雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:

①由图1可知SCR技术中的氧化剂为。
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图2所示,脱氮效果最佳的c(NO2)/c(NO)=。当NO2与NO的物质的量之比为1:1时,用氨脱氮,每生成1molN2放出的热量为QkJ,写出该反应的热化学方程式。
(3)海水具有良好的吸收SO2的能力,其吸收过程如下:
①SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32-,SO32-可以被海水中的溶解氧氧化为SO42-。海水的pH会(填“升高” 、“不变”或“降低”)。
②SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是。
(4)碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可将SO2通入TeCl4的酸性溶液中进行“还原”得到碲,该反应的化学方程式是_________。
有机物K是制备液晶材料的重要中间体,其合成途径如下:
已知:一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
请回答下列问题:
(1)A的核磁共振氢谱有2种峰,则A的结构简式为。
(2)写出K中存在的官能团的名称。
(3)反应Ⅳ在(1)条件下的离子方程式为。
(4)反应Ⅰ→Ⅴ中属于氧化反应的有。
(5)根据反应Ⅱ的信息完成以下反应方程式:
(6)反应Ⅲ需试剂与条件是:。
(7)已知X为E的同分异构体,X与硬酯酸甘油脂具有相同的官能团,还能发生银镜反应。写出所有满足条件的X的结构简式:。