X、Y、Z、W是元素周期表中前30号元素,且原子序数依次增大。其相关信息如下表:
| 元素 |
相关信息 |
| X |
X原子基态时最外层电子数是其内层电子总数的2倍 |
| Y |
Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z |
Z元素的最高正价与负价代数和为6 |
| W |
W基态原子未成对电子数是前30号元素中最多的 |
(1)W位于元素周期表第 周期第 族,其基态原子最外层有 个电子。
(2)X的第一电离能比Y的 (填“大”或“小”),1mol X22-中含有的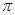 键数目为 。
键数目为 。
(3)X和Y的气态氢化物中,较稳定的是 (写化学式),Y的同族元素(包括Y)的最简单氢化物中沸点最低的是 。
(4)写出KZY3与HZ浓溶液反应制取Z2的化学方程式,并标出电子转移的方向和数目
。
(5)已知:X(s)+Y2(g)=XY2(g) ΔH 1= -393.5 kJ•mol-1
XY(g) +1/2Y2(g)=XY2(g) ΔH 2= -282.9 kJ•mol-1
则X(s)与Y2(g)反应生成XY(g)的热化学反应方程式为 。
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度的升高,混合气体的颜色变深。
2NO2(g),随温度的升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H0(填“>”或“<”);
100℃时,体系中各物质浓度随时间变化如图所示。
在0~60s时段,反应速率v(N2O4)为mol•L-1•s-1;反应的平衡常数K1=mol/L。
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡。则:
① T100℃(填“>”或“<”)。
② 计算温度T时反应的平衡常数K2=mol/L。
(3) 温度T时反应达平衡后,将反应容器的容积减少一半,则平衡向(填“正”或“逆”)反应方向移动。
在2L密闭容器中,充入a molN2和b molH2,在一定温度下N2+3H2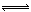 2NH3,达到平衡,容器中还剩余c molN2,则平衡时N2的转化率是,H2的转化率是,容器中H2的平衡浓度是mol/L,该温度下平衡常数的数值为。(用a、b、c表示出计算式即可)
2NH3,达到平衡,容器中还剩余c molN2,则平衡时N2的转化率是,H2的转化率是,容器中H2的平衡浓度是mol/L,该温度下平衡常数的数值为。(用a、b、c表示出计算式即可)
(10分) 用“>”、“=”、“<”填写。
(1)常温下,将0.1mol/L的醋酸溶液和0.1mol/L醋酸钠溶液等体积混合,测得溶液显酸性,则该混合液中: c(CH3COOH)c(CH3COO-);2c(Na+)c(CH3COO-)+c(CH3COOH);
(2)常温下,将0.1mol/L的HCN溶液和0.1mol/L的NaCN溶液等体积混合,测得混合液中c(HCN)>c(CN-),(假设混合过程中溶液体积的改变忽略不计)。则该混合液pH7,c(HCN)+c(CN-)0.1mol/L, c(HCN)-c(CN-)2c(OH-)。
请写出下列溶液水解(或双水解)的离子反应方程式:
(1)次氯酸钠溶液:
(2)硫酸铵溶液:
(3)明矾净水原理:
(4)泡沫灭火器工作原理:
(5) 氯化铁溶液与偏铝酸钾溶液混合:
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g) + O2(g)  2NO(g) △H > 0
2NO(g) △H > 0
已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该反应的平衡常数表达式为。
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是%(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是
。
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是(填字母序号)。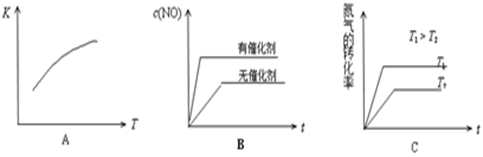
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数(填“变大、“变小”或“不变”)。