氢气是一种清洁能。用甲烷制取氢气的两步反应的能量变化如下图所示:
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(2)第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为 ,随着温度升高该反应的化学平衡常数的变化趋势是 。
(3)在恒温恒容密闭容器中进行的第II步反应,下列说法中能表示达到平衡状态的是_______(填序号)。
a.四种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
b. 单位时间内断开amol H-H键的同时断开2a mol O-H键
c. 反应容器中放出的热量不再变化
d. 混合气体的密度不再发生变化
e. 混合气体的压强不再发生变化
(4)某温度下,第II步反应的平衡常数为K=1/9。该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示。下列判断不正确的是 。
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2O)/ mol/L |
0.010 |
0.020 |
0.020 |
| c(CO)/ mol/L |
0.010 |
0.010 |
0.020 |
A. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B. 平衡时,甲中和丙中H2O的转化率均是25%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.015mol/L
D. 平衡时,乙中H2O的转化率大于25%
(物质结构与性质)
Ⅰ.下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)请写出元素D的基态原子电子排布式___________________。
(2)元素A、B形成的单质中,______对应的单质熔点更高,原因是_________________。
(3)写出C的最高价氧化物的水化物与B的最高价氧化物的水化物反应的化学方程式_______________。
(4)元素D可以形成化学式为D(NH3)5BrSO4,配位数均为6的两种配合物。若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为____________。
Ⅱ.钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态:+2价和+3价。
(5)根据图示晶胞结构,推算晶体中Y,Ba,Cu和O原子个数比,确定其化学式为________。
Ⅲ.BF3与一定量的水形成晶体Q [(H2O)2·BF3],Q在一定条件下可转化为R:
(6)晶体Q中各种微粒间的作用力不涉及________(填字母)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.范德华力
(7)R中阳离子的空间构型为________,阴离子的中心原子轨道采用_____杂化。
A、B、C、D是四种常见的有机物,其中,A是一种气态烃,在标准状况下的密度是1.25 g/L ,其产量是衡量一个国家石油化工发展水平的标志之一;C的分子式为C2H4O2;B和C在浓硫酸和加热的条件下发生反应,生成的有机物有特殊的香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):
根据以上材料和你所学的化学知识回答下列问题:
(1)B中所含官能团名称:________________,C中所含官能团名称______________
(2)丙烯酸(CH2 =" CH" — COOH)的性质可能有()
① 加成反应②取代反应 ③加聚反应 ④中和反应⑤氧化反应
A.只有①③B.只有①③④ C.只有①③④⑤ D.①②③④⑤
(3)写出下列反应方程式
①A B:_______________________________反应类型:________________
B:_______________________________反应类型:________________
②丙烯酸 + B 丙烯酸乙酯 :__________________________ 反应类型:______________
丙烯酸乙酯 :__________________________ 反应类型:______________
(4)聚丙烯酸的结构简式______________,丙烯中最多有_____________个原子共面。
海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题: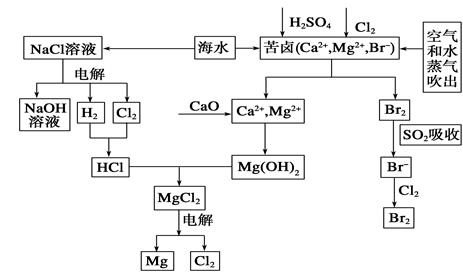
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式)_________________________。
(2)①目前较先进的电解制碱法是离子交换膜电解法,即用阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是____________________,电解饱和食盐水的化学反应方程式为___________________。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O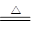 MgCl2+6H2O,该反应要在HCl气氛中进行,原因是__________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是__________。
(3)苦卤中通入Cl2已经置换出Br2,为什么吹出后用SO2吸收转化为Br-再用Cl2置换______________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_________________;最后再用H2SO4处理得到Br2,该反应的离子方程式是__________________。
(9分)金刚烷是一种重要的化工原料,工业上可通过下列途径制备:
(1)环戊二烯分子中最多有个原子共平面;
(2)金刚烷的分子式为,其分子中的-CH2-基团有个;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:
其中,反应①的产物名称是, 反应②的反应试剂和反应条件,反应④的反应类型是;
(4)已知烯烃能发生反应:
请写出下列反应产物的结构简式: 。
。
有机化学反应因反应条件不同,可生成不同的有机产品。例如: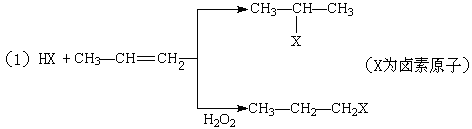
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。
工业上利用上述信息,按下列路线合成结构简式为 的物质,该物质是一种香料。
的物质,该物质是一种香料。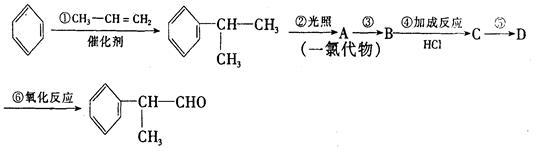
请根据上述路线,回答下列问题:
(1)A的结构简式可能为____________________________________。
(2)反应①、⑤的反应类型分别为________、_______。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):_______________________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是______________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写三种):
______________________________。