A、B、C、D是四种常见的有机物,其中,A是一种气态烃,在标准状况下的密度是1.25 g/L ,其产量是衡量一个国家石油化工发展水平的标志之一;C的分子式为C2H4O2;B和C在浓硫酸和加热的条件下发生反应,生成的有机物有特殊的香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):
根据以上材料和你所学的化学知识回答下列问题:
(1)B中所含官能团名称:________________,C中所含官能团名称______________
(2)丙烯酸(CH2 =" CH" — COOH)的性质可能有( )
① 加成反应 ②取代反应 ③加聚反应 ④中和反应 ⑤氧化反应
A.只有①③ B.只有①③④ C.只有①③④⑤ D.①②③④⑤
(3)写出下列反应方程式
①A B:_______________________________反应类型:________________
B:_______________________________反应类型:________________
②丙烯酸 + B 丙烯酸乙酯 :__________________________ 反应类型:______________
丙烯酸乙酯 :__________________________ 反应类型:______________
(4)聚丙烯酸的结构简式______________,丙烯中最多有_____________个原子共面。
大气中的部分碘源于
对海水中
的氧化。将
持续通入
溶液中进行模拟研究。
(1)
将
氧化成
的过程由3步反应组成:
①
②
③
总反应的化学方程式为,其反应
=。
(2)在溶液中存在化学平衡:
,其平衡常数表达式为。
(3)为探究
对氧化
反应的影响(反应体系如图13),某研究小组测定两组实验中
浓度和体系
,结果见图14和下表。

| 编号 |
反应物 |
反应前 | 反应后 |
| 第1组 |
+
|
5.2 |
11.0 |
| 第2组 |
+
+
|
5.2 |
4.1 |
①第1组实验中,导致反应后
升高的原因是。
②图13中的
为。由
生成
的过程能显著提高
的转化率,原因是。
③第2组实验进行18
后,
下降。导致下降的直接原因有(双选)。
A.
减小 B.
减小 C.
不断生成 D.
增加
(4)据图14,计算3~18
内第2组实验中生成
的平均反应速率(写出计算过程,结果保留两位有效数字)。
脱水偶联反应是一种新型的直接烷基化反应,例如: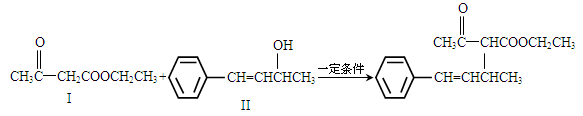
(1)化合物
的分子式为,1
该物质完全燃烧最少需要消耗
。
(2)化合物
可使溶液(限写一种)褪色;化合物
(分子式为
)可与
水溶液共热生成化合物
,相应的化学方程式为。
(3)化合物
与NaOH乙醇溶液共热生成化合物
,
的核磁共振氢谱除苯环峰外还有四组峰,峰面积之比为为1∶1∶1∶2,
的结构简式为。
(4)由
可合成化合物
。化合物V是
的一种无支链同分异构体,碳链两端呈对称结构,且在
催化下与过量
反应生成能发生银镜反应的化合物
。
的结构简式为,
的结构简式为。
(5)一定条件下, 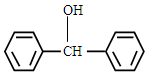 与
与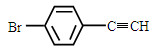 也可以发生类似反应①的反应,有机产物的结构简式为。
也可以发生类似反应①的反应,有机产物的结构简式为。
化合物
是一种环境激素,存在如下转化关系:
化合物
能与
溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,其苯环上的一硝基取代物只有两种。1H-NMR谱显示化合物
的所有氢原子化学环境相同。
是一种可用于制备隐形眼镜的高聚物。
根据以上信息回答下列问题。
(1)下列叙述正确的是。
| A. | 化合物 分子中含有联苯结构单元 |
| B. | 化合物 可以和 溶液反应,放出 气体 |
| C. | 与 溶液反应,理论上1 mol 最多消耗6 mol |
| D. | 化合物 能与 发生加成反应 |
(2)化合物
的结构简式是,
的反应类型是。
(3)写出同时满足下列条件的D的所有同分异构体的结构简式(不考虑立体异构。
a.属于酯类 b.能发生银镜反应
(4)写出
反应的化学方程式。
(5)写出
反应的化学方程式。
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 反应过程 |
化学方程式 |
焓变 | 活化能 |
| 甲烷氧化 |
-802.6 |
125.6 |
|
| -322.0 |
172.5 |
||
| 蒸汽重整 |
206.2 |
240.1 |
|
| 165.0 |
243.9 |
回答下列问题:
(1)反应
的
=kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以平衡常数(记作KP),则反应CH4(g)+H2O(g) CO(g)+3H2(g)的KP=;
CO(g)+3H2(g)的KP=;
随着温度的升高,该平衡常数(填"增大"、"减小"或"不变")。
(4)从能量阶段分析,甲烷自热重整方法的先进之处在于。
(5)在某一给定进料比的情况下,温度、压强对
和
物质的量分数的影响如下图: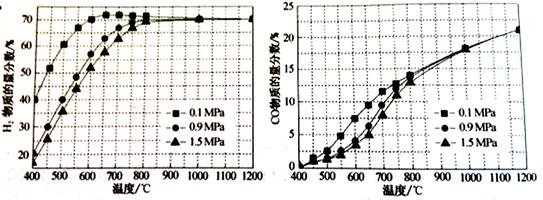
①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是。
A.600℃,0.9Mpa B.
C.
D.
②画出
条件下,系统中
物质的量分数随反应时间(从常温进料开始即时)
的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
已知:
+2

 +2
。相关物质的溶度积常数见下表:
+2
。相关物质的溶度积常数见下表:
| 物质 |
||||
| 2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性
溶液中含有少量的
,为得到纯净的
晶体,加入调至
=4,使溶液中的
转化为
沉淀,此时溶液中的
=;
过滤后,将所得滤液低温蒸发、浓缩结晶,可得到
晶体。
(2)在空气中直接加热
晶体得不到纯的无水
,原因是。(用化学方程式表示)。由
晶体得到纯的无水
的合理方法是。
(3)某学习小组用"间接碘量法"测定含有
晶体的试样(不含能与I―发生反应的氧化性质杂质)的纯度,过程如下:取0.36
试样溶于水,加入过量
固体,充分反应,生成白色沉淀。用0.1000
标准溶液滴定,到达滴定终点时,消耗
标准溶液20.00
。
①可选用作滴定指示荆,滴定终点的现象是。
②
溶液与
反应的离子方程式为。
③该试样中
的质量百分数为.