Ⅰ、某化学研究性学习小组为探究元素性质的变化规律,设计了如下实验:
(1)甲同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其设计的依据是 ;但该装置存在缺陷,请指出 。
(2)乙同学设计了如图2装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。乙同学可能观察到的现象A. ;B. ;C. 。从环保角度考虑,该装置有明显不足,请指出提出改进建议 。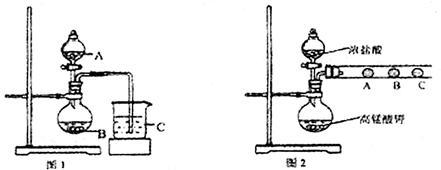
Ⅱ、另一化学研究性学习小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。
步骤一:电解精制:
电解时,粗铜应与电源的 极相连。阴极上的电极反应式为 。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式:
。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的信息:
| 序号 |
反应 |
平衡常数 |
| 1 |
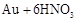  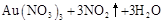 |
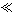 1 1 |
| 2 |
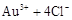  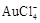 |
 1 1 |
请根据以上信息简要解释溶解阳极泥能够溶于王水的原因
。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程。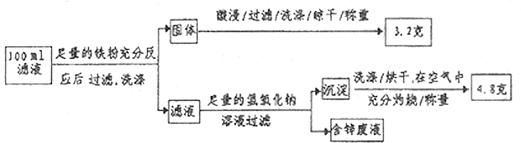
则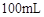 滤液中
滤液中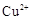 的浓度为
的浓度为  ,
,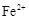 的浓度为
的浓度为  。
。
氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与氢氧化钠溶液反应)中A1N的含量,某实验小组设计了如下两种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案l】取一定量的样品,用以下装置测定样品中AIN的纯度(夹持装置已略去)。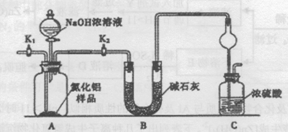
(1)上图C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先 ,再加入实验药品。接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)若去掉装置B,则导致测定结果 (填“偏高”、“偏低”或“无影响”)。由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见 。
【方案2】按以下步骤测定样品中A1N的纯度: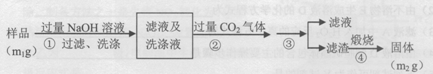
(4)步骤②生成沉淀的离子方程式为 。
(5)步骤③的操作是 。A1N的纯度是 (用m1、m2表示)。
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下: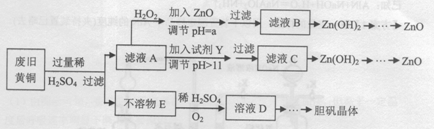
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。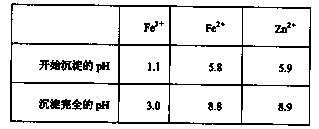
请回答下列问题:
(1)加入ZnO调节pH=a的目的是 ,a的范围是 。
(2)由不溶物E生成溶液D的化学方程式为 。
(3)滤液A中加入H202反应的离子方程式为 。
(4)由溶液D制胆矾晶体包含的主要操作步骤是 。
(5)下列试剂可作为Y试剂的是 。
| A.ZnO | B.NaOH | C.Na2CO3 | D.ZnSO4 |
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是 。
欲测定镁铝合金中金属铝的百分含量
Ⅰ:甲同学利用下图所给的仪器组成一套实验装置(仪器不一定全选,已知:室温时的气体摩尔体积为24.0 L/mol)。
填写下列各项(气流从左到右):
(1)装置中导管W的作用是 。
(2)各种仪器的连接顺序(填接口字母)是。
(3)连接好仪器后,要进行以下操作,其先后顺序是(填序号)。
①待装置中的温度恢复至室温;
②擦掉镁铝合金条表面的氧化膜,将其置于电子天平上称量质量为0.39 g,并将其投入锥形瓶中;
③检查装置的气密性;
④旋开装置A中分液漏斗的活塞,使其中的稀盐酸顺利流下,当合金条完全溶解时再关闭活塞,此时A中共加入稀盐酸10 mL;
⑤测得量筒中水的体积为480 mL。
(4)根据实验数据计算合金中铝的质量百分数(保留小数点后一位数字)。
(5)读数时除上述①注意事项外,还应有 (写出一点即可)。
Ⅱ:乙同学的方案:称量0.39 g 镁铝合金条,放在如图所示装置的惰性电热板上,通电使其灼烧。欲计算铝的百分含量,该实验还需要测定的数据是。丙同学提出该实验可能会存在较大误差,其理由是。
Ⅲ:丁同学另称量3.9 g的同样的镁铝合金条,投入VmL 1mol/L的NaOH溶液中,充分反应后,过滤、洗涤、干燥、称量固体质量,再计算铝的含量,与甲同学的测量结果相同。写出发生反应的离子方程式,计算NaOH溶液的体积V≥ mL。
(14分)环己酮是重要化工原料,可用于制造尼龙、己二酸等产品。可以尝试用次氯酸钠氧化环己醇制环己酮: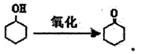
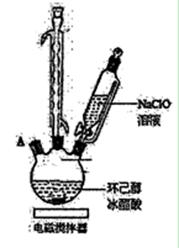
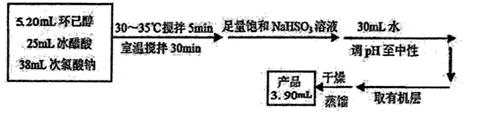
(1)实验中盛装NaClO溶液的仪器比普通分液漏斗多了一个侧管,此设计的目的为。
(2)次氯酸钠氧化环己醇的反应放出大量的热,为了将体系温度维持在30~35 ℃,除了用冰水浴冷却外,采取的措施还可能有____,并应在三颈瓶的A端口处应补加(仪器名称)。
(3)实验过程中NaClO溶液氧化环己醇的化学方程式为。
(4)为将溶液的pH调至中性,可以加入的试剂是。
A、防止因温差过大,水冷凝管易炸裂
B、空气冷凝管结构简单,易于安装
C、空气冷凝管冷凝效果更佳
(6)计算本实验过程中环己酮的产率。
(15分)本题由I,II两部分组成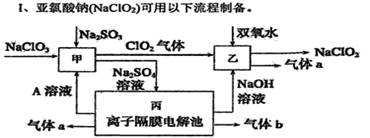
(1)A的化学式是,甲中发生反应的化学方程式为。
(2)乙中反应的离子方程式是。
(3)装置丙产生气体b的电极反应式为。
II、某溶液仅含下列离子中的几种,且所含各种离子的物质的量浓度均为0.lmol/L(忽略水的电离及离子的水解)。K+Ag+ Mg2+Al3+ NH4+Cl- CO32- NO3-SO42- I-
用如下各步实验分析该溶液组成:
①取5 mL溶液,滴少量稀氨水,发现溶液中有沉淀生成,且离子种类增加。
②用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钻玻璃观察,火焰不显紫色。
③另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
④向步骤③实验所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请回答下列问题:
(4)由步骤②判断,溶液中一定不含有的阳离子是____;步骤③中生成无色气体的化学式是__。
(5)最终确定溶液中所含阴离子有__。
(6)另取100 mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体化学式为____。