某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO2,其实验流程图如下:
(1)测定硝酸的物质的量反应结束后,从如下图B装置中所得100mL溶液中取出25.00ml溶液,用0.1mol/L的NaOH溶液滴定,用酚酞作指示,滴定前后的滴定管中液面的位置如上图所示,在B容器中生成硝酸的物质的量为 ,则Ag与浓硝酸反应过程中生成的NO2的物质的量为 。
(2)测定NO的体积
①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验,选用的理由是 。
②在读取量筒内液体体积之前,应进行的操作 。
(3)气体成分分析
若实验测得NO的体积为112.0ml(已折算到标准状况),则Ag与浓硝酸反应的过程中 (填“有”或“没有”)NO产生,作此判断的依据是 。
已知下表所示数据:
| 物质 |
熔点(℃) |
沸点(℃) |
密度(g·cm-3) |
| 乙醇 |
-117.3 |
78.5 |
0.79 |
| 乙酸 |
16.6 |
117.9 |
1.05 |
| 乙酸乙酯 |
-83.6 |
77.5 |
0.90 |
| 浓硫酸 |
338.0 |
1.84 |
某学生实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比2∶3∶3配制浓硫酸、乙醇和乙酸的混合溶液。
②按图甲连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管 5~ 10 min。
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层。
④分离出乙酸乙酯层,洗涤、干燥。
请根据题目要求回答下列问题:
(1)配制该混合液的主要操作步骤为___________________。
(2)导管不能插入到Na2CO3溶液中的原因是____________________________。
(3)步骤②中需要小火均匀加热,其主要原因是________________________________。
(4)指出步骤③所观察到的现象:_______________________________________;
(5)充分振荡试管,然后静置,待液体分层后,分液得到的上层液体即为乙酸乙酯。分离出乙酸乙酯层后,可以用用________________________洗涤.
A.乙醇B.饱和食盐水
C.饱和碳酸钠溶液 D.NaOH溶液
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液。请回答:
(1)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:______________________________
(2)球形干燥管除起冷凝作用外,另一重要作用是_________________。
(3)若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)__________ _;反应结束后D中的现象是________________________。
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示。可能用到的有关数据如下: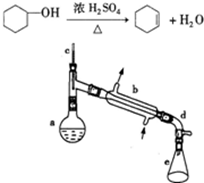
| 相对分子质量 |
密度/(g•cm-3) |
沸点/℃ |
溶解性 |
|
| 环乙醇 |
100 |
0.9618 |
161 |
微溶于水 |
| 环己烯 |
82 |
0.8102 |
83 |
难溶于水 |
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:将馏出物倒入分液漏斗中依次用少量5%碳酸钠溶液和蒸馏水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是 _____________。
(2)加入碎瓷片的作用是__________,如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是____________(填正确答案标号)
A.立即补加B.冷却后补加C.不需补加D.重新配料
(3)本实验中最容易产生的有机副产物为 _________________。
(4)在本实验分离过程中,产物应该从分液漏斗的______(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是_________________________。
(6)本实验所得到的环己烯产率是____________。
实验室制备1,2-二溴乙烷的反应原理如下:
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如下:
| 乙醇 |
1,2-二溴乙烷 |
乙醚 |
|
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g•cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
-130 |
9 |
-116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(2)反应过程中A装置可能产生的酸性干扰气体(填化学式),为此在装置C中应加入_____ (从下列选项中选择)以吸收除杂。
a.水 b.浓硫酸 c.氢氧化钠溶液d.高锰酸钾溶液
(3)装置B是安全瓶,其工作原理是。
(4)若产物中有少量未反应的Br2,最好用下列试剂中的洗涤(填选项符号),再通过的方法分离;
a.水 b.氢氧化钠溶液 c.NaHSO3溶液 d.苯
(5)若产物中有少量副产物乙醚,可用的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是;但又不能过度冷却(如用冰水),其原因是。
(共11分)实验室制备1,2—二溴乙烷的反应原理如下:
可能存在的的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用16.0g的溴和足量的乙醇制备1,2—二溴乙烷,实验结束后得到9.4g产品。实验装置如下图所示:
有关数据列表如下:
| 乙醇 |
1,2—二溴乙烷 |
乙醚 |
|
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度 / g·cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点 / 0C |
78.5 |
132 |
34.6 |
| 熔点 / 0C |
-130 |
9 |
-116 |
| 溶解性 |
易溶水 |
难溶水 |
微溶于水 |
请回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其主要目的是(填正确选项前的字母);
a、引发反应 b、加快反应速度
c、防止乙醇挥发 d、减少副产物乙醚生成
(2)在装置C中应加入,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a、水 b、浓硫酸 c、氢氧化钠溶液 d、酸性KMnO4溶液
(3)判断该制备反应已经结束的最简单的方法是。
(4)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层(填“上”或“下”);
(5)在装置B中较长玻璃导管的作用是;
(6)反应过程中应用冷水冷却装置D,其主要目的是,但又不能过度冷却(如用冰水),其原因是;
(7)本实验中,1,2—二溴乙烷的产率为。