(共11分)实验室制备1,2—二溴乙烷的反应原理如下:
可能存在的的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用16.0g的溴和足量的乙醇制备1,2—二溴乙烷,实验结束后得到9.4g产品。实验装置如下图所示:
有关数据列表如下:
| |
乙醇 |
1,2—二溴乙烷 |
乙醚 |
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度 / g·cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点 / 0C |
78.5 |
132 |
34.6 |
| 熔点 / 0C |
-130 |
9 |
-116 |
| 溶解性 |
易溶水 |
难溶水 |
微溶于水 |
请回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其主要目的是 (填正确选项前的字母);
a、引发反应 b、加快反应速度
c、防止乙醇挥发 d、减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a、水 b、浓硫酸 c、氢氧化钠溶液 d、酸性KMnO4溶液
(3)判断该制备反应已经结束的最简单的方法是 。
(4)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”或“下”);
(5)在装置B中较长玻璃导管的作用是 ;
(6)反应过程中应用冷水冷却装置D,其主要目的是 ,但又不能过度冷却(如用冰水),其原因是 ;
(7)本实验中,1,2—二溴乙烷的产率为 。
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。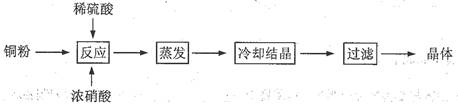
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:、。
(2)有同学认为此种方法会生成有毒的氮的氧化物, 且所得晶体可能混有硝酸铜。建议将浓硝酸换成其它氧化剂,你觉得呢?若有同感,请选择合适的试剂完成下列反应(若有反应条件的应注明):
__Cu + __H2SO4 + __________→ __CuSO4 +_______________
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4
相对分子质量:CuSO4:160 H2O:18
称取0.1000 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则该试样中含CuSO4·5H2O的质量分数为。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用。
(5)如果采用重量法测定CuSO4·5H2O的含量,完成下列步骤:
①称取样品a g②加水溶解③加氯化钡溶液,沉淀④过滤、、干燥⑤称量所得固体b g。
在过滤前,需要检验是否沉淀完全,其操作是
则a g该试样中含CuSO4·5H2O的质量为g (用含b的代数式表示)。
[相对原子质量:H-1 O-16 S-32 Ba-137]
某研究性小组设想将少量Cl2通入Fe2+和I-的混合溶液中,探究Fe2+和I-的还原性强弱。
[提出假设]
假设1:Fe2+的还原性比I-强
假设2:I-的还原性比Fe2+强
假设1:一样强
[验证假设]
(1)设计如下几种装置进行实验:
实验必须的装置是A→_______________(按Cl2气流方向的顺序填写)
(2)实验开始后,控制通入少量Cl2,通过观察混合溶液颜色的变化_________(填“能”或“不能”)判断反应的先后顺序。
(3)请在下表中写出实验步骤及预期现象和结论:
| 实验步骤 |
预期现象和结论 |
| 取少量反应后的混合溶液分置于A、B两试管中; 往A中滴加__________溶液 往B中滴加__________溶液 |
①若_______________________________ ________________________,则假设1成立 ②若____________________________ ________________________,则假设2成立 ③若______________________________ ______________________,则假设3成立 |
(4)为了实验成功,必须控制各物质的用量。该小组称取1.52 g FeSO4,同时称取1.66g KI固体,溶于水中。为了验证上述假设,通入的Cl2体积最多不能超过__________L(标准状况)。[相对分子质量:FeSO4 :152 KI :166 ]
[思考与交流]
(5)有同学质疑,上述实验只能验证Cl2分别与Fe2+和I-反应的速率大小,并不能证明Fe2+和I-的还原性强弱。于是提出另一方案:往KI溶液中滴入__________溶液,如果能发生反应,即可证明和I-的还原性强于Fe2+。该反应的离子方程式为:____________________
下图所示装置是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去)。请根据下列要求回答问题。
(1)若烧瓶中盛装Zn片,分液漏斗中盛装稀H2SO4,则:
①当制备H2、验证H2的还原性并检验H2的氧化产物,仪器连接顺序为:A→C→B
→B→D时,两次使用B装置,其中所盛的药品依次是、
(写化学式);D装置的作用是
。
②上述实验中为了使H2产生的速率不至于过快,在不改变现有药品的条件下,可采取的方法有、
。(要求:写出的两种方法原理不同)
(2)若烧瓶中盛装Na2O2,分液漏斗中盛装浓氨水,则:
①烧瓶内除了能产生O2外,还能产生大量NH3。能产生大量NH3的原因是:
a;b;c。
②用产生的气体做氨的催化氧化实验,各仪器装置按气流方向(从左到右)连接顺序是:A→→→(填正确序号的字母)此时在其中的一个装置中可能会出现大量红棕色气体,该装置是(用字母表示);用化学方程式解释红棕色气体产生的原因:、
。
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。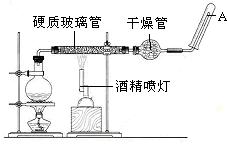
请回答该实验中的问题。
(1)写出该反应的反应方程式:;并指明该氧化还原反应的还原剂是,氧化剂是。
(2)实验前必须对整套装置进行气密性检查,操作方法是。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是。
(4)干燥管中盛装是的物质是,作用是。
( 5)试管中收集气体是,如果要在A处玻璃管处点燃该气体,则必须对该气体进行,方法是。这一操作的目的是。
某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是。
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片
实验记录(填空,划线部分不必填写):
| 序号 |
实验内容 |
实验现象 |
离子方程式 |
实验结论 |
| ① |
在FeCl2溶液中滴入适量氯水 |
溶液由浅绿 色变为棕黄色 |
Fe2+具有还原性 |
|
| ② |
在FeCl2溶液中加入锌片 |
————— |
Zn+Fe2+=Zn2++Fe |
|
| ③ |
在FeCl3溶液中加入足量铁粉 |
Fe+2Fe3+=3 Fe2+ |
Fe3+具有氧化性 |
|
| ④ |
——————— |
————— |
Fe3+具有氧化性 |
实验结论
(3)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化。