以磷石膏(只要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3。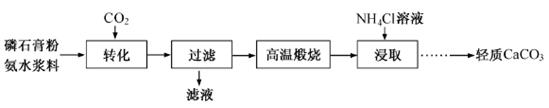
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见下图。清液pH>11时CaSO4转化的离子方程式____________;能提高其转化速率的措施有____(填序号)
| A.搅拌浆料 | B.加热浆料至100℃ |
| C.增大氨水浓度 | D.减小CO2通入速率 |
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为______和________(填化学式);检验洗涤是否完全的方法是_________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因___________。
某地煤矸石经预处理后主要含SiO2(61%)、Al2O3(30%)和少量的Fe2O3、FeO及钙镁的化合物等。某实验小组利用其提取Al(OH)3。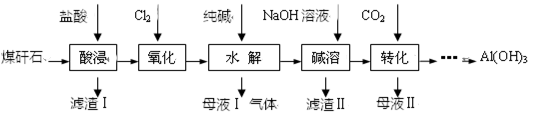
(1)“酸浸”过程中发生的主要反应的离子方程式为。为提高“酸浸”时铝浸出率,可采取的措施之一是。
(2)“氧化”的目的是。检验Fe3+已水解完全的方法是。
(3)滤渣Ⅱ的主要成分是CaCO3、Mg(OH)2和。
(4)①上述流程中可循环利用的物质的化学式是。
②“转化”时主要反应的离子方程式为。
(5)Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得产品Al(OH)3,从氧化后的溶液开始,若只用纯碱一种试剂,后续操作是。
某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然
氨气具有还原性,氨气能否象H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)实验室用装置A可快速制取氨气,写出反应的化学方程式。
(二)实验探究
该小组成员设计实验探究氨气还原性及其产物,实验装置(夹持及尾气处理装置未画出)图如下:
(2)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是。
(3)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式。
(三)问题讨论
(4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知Cu2O是红色粉末,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu。请你设计一个简单的实验检验该红色物质中是否含有Cu2O:。
(5)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 g Cu(OH)2固体,加热到80℃~100℃时,得到黑色固体粉未,继续加热到1000℃以上,黑色粉未全部变成红色粉未A。冷却后称量,A的质量为72 g。
据此可推得A为,请写出上述过程中发生反应的两个化学方程式,由此得到的结论是。
(16分)锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,工业上可通过控制条件逐一除去杂质以制备超细活性氧化锌,其工艺流程如下:
(1)锌浮渣利用硫酸浸出后,将滤渣1进行再次浸出,其目的是。
(2)净化1是为了将Mn2+转化为MnO2而除去,试写出该反应的离子方程式。
(3)90℃时,净化2溶液中残留铁的浓度受pH影响如图。pH值中等时,虽有利于Fe2+转化为Fe3+,但残留铁的浓度仍高于pH为3~4时的原因是。
(4)滤渣3的主要成份为(填化学式)。
(5)碳化在50℃进行,“前驱体”的化学式为ZnCO3•2Zn(OH)2•H2O,写出碳化过程生成“前驱体”的化学方程式;碳化时所用NH4HCO3的实际用量为理论用量的1.1倍,其原因一是为了使Zn2+充分沉淀,二是。
实验室从含碘废液(含有H2O 、CCl4、I2、I-等)中回收碘,操作过程如下:
(1)向废液中加入Na2SO3溶液,发生“还原”反应的离子方程式为。
(2)“氧化”操作在三颈烧瓶中进行(如图一),将溶液用盐酸调至pH约为2,缓慢通入Cl2。实验用水浴控制在40℃左右的较低温度下进行的原因是。
(3)某研究小组用图二装置对Cl2与KI溶液的反应进行探究,发现通入Cl2一段时间后,KI溶液变为黄色,继续通入Cl2,则溶液黄色变浅,最后变为无色。研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:
假设一:没有I2形态;假设二:没有I-形态;假设三:有IO3-形态。
①请设计实验证明假设一成立(试剂自选)。
| 实验操作 |
预期现象 |
结论 |
| 假设一成立 |
②若假设三成立,请写出生成IO3-的离子方程式。
(4)该研究小组还进行了对加碘盐中KIO3含量测定的如下实验:
①准确称取加碘盐m g于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成250.00mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉试液,用c mol•L-1 Na2S2O3标准液滴定至终点,重复3次,测得平均值为V mL。
已知:IO3-+ 5I-+6H+ =3H2O+3I2,I2 +2S2O32-=2I-+S4O62-。测定时,判断达到滴定终点的现象为。由测定数据可求得该样品中含KIO3的质量分数为(用含m、c、V的代数式表示,Mr(KIO3)=214)。
②在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因。
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3、Fe2O3等杂质。以铬铁矿为原料制备重铬酸钾(K2Cr2O7)、重铬酸钠(Na2Cr2O7)的过程如下图所示。
已知:①NaFeO2遇水强烈水解:NaFeO2 + 2H2O=NaOH + Fe(OH)3↓;
②Cr2O72-+ H2O  2CrO42- + 2H+。
2CrO42- + 2H+。
请回答:
(1)“焙烧”后的固体产物成分除Na2CrO4、NaFeO2外,还有(填化学式)
等。写出“焙烧”过程中所发生的氧化还原反应的化学方程式。
(2)“焙烧”过程中,所产生X气体的电子式为。
(3)“水浸”步骤中,为了提高浸出率,可采取的措施有(请写出两条):;。
(4)滤渣1的主要成分是。若要进一步分离滤渣2 中的可酸溶成分,请写出酸溶时发生反应的离子方程式。
(5)含Na2Cr2O7的“混合溶液”经过蒸发并冷却至30~40℃得到的Na2Cr2O7晶体还要进行重结晶,其目的是进一步减少晶体中杂质(填化学式)的含量。
(6)操作Ⅲ由多步组成,向含Na2Cr2O7的母液中加入KCl固体,最终获得K2Cr2O7晶体的操作依次是、、过滤、75%乙醇水溶液洗涤、干燥。