绿矾是一种重要的化工原料。
【问题1】绿矾晶体(FeSO4·7H2O)由于保存不妥或长久放置,容易被空气中的氧气氧化而变质。为探究绿矾样品的变质情况,某化学兴趣小组的同学设计了下列实验方案。
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液。
(1)方案1:取少量溶液,加入几滴 试剂(写化学式),如果观察到的现象是溶液变血红色;实验结论:证明绿矾样品已被氧化。
(2)方案2:取少量溶液,加入几滴酸性KMnO4溶液,如果观察到的现象是 。实验结论:证明绿矾样品完全被氧化。
(3)使用FeSO4时,如要防止Fe3+的干扰,可以加入适量铁粉进行除杂,写出加入铁粉后发生反应的离子方程式 。
(4)要从FeSO4溶液中得到绿矾晶体,必须进行的实验操作步骤: 、冷却结晶、 过滤、自然干燥,在这一系列操作中没有用到的仪器有 (此空填序号)
| A.蒸发皿 | B.石棉网 | C.烧杯 | D.玻璃棒 |
【问题2】灼烧绿矾的反应方程式:2(FeSO4·7H2O) Fe2O3+SO2↑+SO3↑+14H2O
工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的气体产物中是否含有SO2和SO3,进行如下实验:将FeSO4高温分解产生的气体通入下图所示的装置中。请回答以下问题: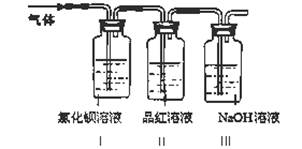
(1)装置I中氯化钡溶液中可观察到现象 。若氯化钡溶液足量,将最后所得沉淀过滤、洗涤、烘干后称重为2.33克,则灼烧绿矾的过程中转移了_________mol的电子。
(2)装置II中试剂为品红溶液,其作用是
(3)装置III中试剂为NaOH溶液,其作用是 。
无水硫酸铜在加热条件下能发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气。某学生试图用下图所示装置来确定该化学反应中各物质的计量关系
试回答:


⑴加热过程中,试管A中发生的实验现象为。
⑵装置E和F的作用是;
⑶该学生使用装置B的本意是除去混合气体中的三氧化硫以提纯氧气,他的做法正确
吗?为什么?
⑷该学生利用上述装置将一定质量的无水硫酸铜置于A中加热使其分解,最后测得氧
气的体积偏小,其原因可能是 (填序号)
| A.无水硫酸铜未完全分解 |
| B.实验结束时装置A中残留有气体 |
C.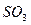 被 被 溶液吸收时产生了 溶液吸收时产生了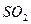 气体 气体 |
| D.最后读量筒中的读数时,E中的液面低于F中的液面 |
⑸另一学生将4.8g无水硫酸铜充分加热使其完全分解后,用正确的实验方法除去了生成物中的二氧化硫和三氧化硫,最后测出氧气的体积为224mL(标准状况)。据此可计算出二氧化硫为mol,三氧化硫为mol。
⑹由上述实验数据可知无水硫酸铜受热分解的化学方程式为:


___________________________________________________________________
某学生做浓硫酸性质的实验: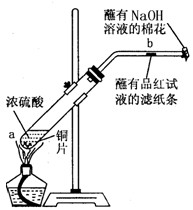
在一支试管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有NaOH溶液的棉花。加热试管,观察现象
回答下列问题:
(1)写出试管中发生反应的化学方程式。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为。
(3)蘸有NaOH溶液的棉花团作用是。
(4)硫酸型酸雨的形成过程可用下列反应中的来表示。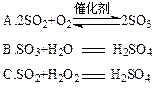
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯。在实验室我们可以用如图所示的装置来制取乙酸乙酯。回答下列问题:
(1)写出试管a中发生的化学方程式:。
(2) 试管b中所盛的溶液为,
试管b中所盛的溶液为,
其主要作用是___________________________。
(3)试管b中的导管要在液面的稍上方,不能插入液面以下,其目的是_____________________ 。
(4)该实验中,若用3mol乙醇和1mol乙酸
在浓硫酸作用下加热,充分反应后,能否生成1mol乙酸乙酯?(填“能”或“不能”),原因是(不考虑原料损耗)。
⑴写出下图石油的蒸馏装置中所指仪器的名称:
a.____________ b._________
⑵指出右图石油的蒸馏装置中的错误之处:
①缺铁圈和
②缺(防液体暴沸)
③
④
乙酸丁酯:(CH3COOCH2CH2CH2CH3)是一种常用的香精,经酯化反应可进行乙酸丁酯的合成。有关物质的物理性质下表。
第一步:将过量的丁醇和乙酸混合加热发生酯化反应;
第二步:水洗提纯;
第三步:蒸馏提纯。
(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)C→F→→→→。
(2)C装置中除了装有乙酸和过量的1-丁醇外,还需要加入_________、_____ ___ 。
(3)装置C中冷凝管的作用是:;冷凝水应从___________(填“c”或“d”)进入冷凝管
(4)步骤F酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是_____ _ _ __。
(5)装置A的分液漏斗中液体分为两层,乙酸丁酯应在(填上、下)层;B装置蒸馏时,接收乙酸丁酯前(温度<126.3℃)锥形瓶中得到的物质是、。