将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘低。 
下列说法正确的是
| A.液滴中的Cl―由a区向b区迁移 |
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e- 4OH- 4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e- Cu2+ Cu2+ |
有机物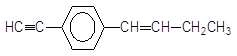 最多可能有多少个碳原子共面:
最多可能有多少个碳原子共面:
| A.12 | B.11 | C.10 | D.9 |
下列有机物在与浓硫酸混合共热的条件下能够生成烯烃的是:
| A.CH3CH2Br | B.(CH3)3CCH2OH | C.CH3CH2OH | D.CH3OH |
下列离子方程式正确的是:
A.足量的乙酸与碳酸钠溶液反应:2H++CO —→CO2↑+H2O —→CO2↑+H2O |
| B.醋酸溶液与新制氢氧化铜反应: 2CH3COOH+Cu(OH)2—→Cu2++2CH3COO-+2H2O |
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O 2C6H5OH+CO 2C6H5OH+CO |
| D.甲醛溶液与足量的银氨溶液共热 |
HCHO+2[Ag(NH3)2]++2OH- CO
CO +2NH
+2NH +Ag↓+3NH3+H2O
+Ag↓+3NH3+H2O
下列说法中正确的是:
| A.不粘锅的涂层是聚四氟乙烯,聚四氟乙烯可以发生加成反应 |
| B.只有与卤原子相连的碳的邻位碳上有氢的卤代烃才能发生水解反应 |
| C.可以用硝酸酸化的硝酸银溶液直接与卤代烃混合的方法判断卤原子的种类 |
| D.溴乙烷在与氢氧化钠的乙醇溶液共热时会发生消去反应 |
下列关于有机物结构、性质的叙述错误的是:
| A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 |
| B.甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 |
| C.蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
| D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中相似的碳碳双键 |