某同学设计了以下操作流程来除去混在氯化钠固体中的少量硫酸钠和氯化钙。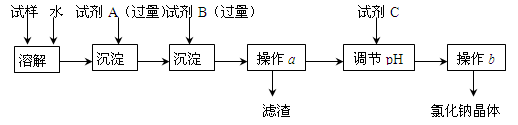
(1)试剂A是 ,试剂A需要过量的原因是 。
(2)操作a得到的滤渣的成分是 ,在实验室中进行操作a需要的仪器是:铁架台(带铁圈)、滤纸、烧杯、 、 。
(3)加入试剂C调节滤液pH的离子反应方程式是 。
(4)该同学想利用上述得到的氯化钠设计一套实验装置来电解饱和食盐水,并检验氯气的氧化性和测定所产生的氢气的体积,部分装置如下图: 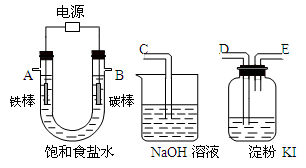
①碳棒接直流电源的_____极; 铁棒上发生的电极反应为 。
②说明氯气具有氧化性的实验现象是 。
③将上图中的仪器,连成一整套装置,各种仪器接口的连接顺(填编号)是B接 , 接 。在答题卡的方框中画出与A接口连接的仪器的装置图。
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含___所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。供选用的试剂:
a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 |
实验现象 |
|
| 方案1 |
||
| 方案2 |
(4)应用与拓展
①在足量的稀氯化亚铁溶液中加入l~2滴溴水,溶液呈黄色,所发生的离子反应方程式为____。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/3的Br—被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为。
纳米TiO2在涂料、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl,再烘干、焙烧除去水分得到粉体TiO2 。用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(1)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_____(填字母代号)。
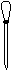
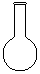

a b c d e
(2)滴定终点的现象是___________________________________________________。
(3)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
(4)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使配制结果______________。
②若在配制标准溶液过程中,俯视液面,使测定结果_________。
我国制碱工业的先驱 侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3(晶体)
依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。
(1)A装置中所发生反应的离子方程式为。
C装置中稀硫酸的作用为。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
参照表中数据,请分析B装置中使用冰水的目的是。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在装置之间(填写字母)连接一个盛有的洗气装置,其作用是。
配制500 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为________。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将________(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为________________________________________________________________。
假定最终称得小烧杯的质量为__________(填“32.6 g”或“31.61 g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程,并在标尺上画出游码的位置(画“△”表示)。
| 砝码质量/g |
50 |
20 |
20 |
10 |
5 |
| 称量(取用砝码过程) |
标尺
(3)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是________。
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤
D.胶头滴管加水后定容时仰视刻度
面粉增白剂主要包括过氧化苯甲酰(俗称面粉增白剂)和过氧化钙两种物质。其中过氧化钙(CaO2)在日常生活和工农业生产中还常用于种子消毒、药物制造、油脂漂白及鱼池增氧等,还可以作为高温氧化剂。已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成。有人提出CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:通过测量气体的体积判断发生的化学反应,实验装置如下: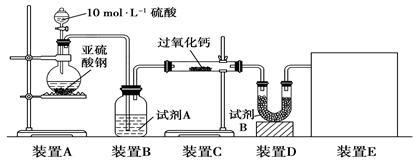
(1)试剂A可以选用________,试剂B的作用是________。
(2)装置E用于测定氧气的体积,请在方框中画出装置图。
(3)实验测得装置C中过氧化钙质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、部分被氧化、完全被氧化的V——m1关系式。
未被氧化:____________,部分被氧化:____________,
完全被氧化:____________。
若SO2完全被氧化,写出反应的化学方程式:___________________________。
实验二:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
提出假设:
假设1:反应后固体只有________,证明SO2未被氧化;
假设2:反应后固体中只有________,证明SO2完全被氧化;
假设3:________________________________________________________。
实验探究:
(4)设计实验,证明假设3是正确的,简要回答实验过程、现象和结论:______
_____________________________________________________________。
实验评价:
(5)实验过程中SO2的通入量直接影响探究实验结果的科学性,请简要说明原因:___________________________________________________________。