面粉增白剂主要包括过氧化苯甲酰(俗称面粉增白剂)和过氧化钙两种物质。其中过氧化钙(CaO2)在日常生活和工农业生产中还常用于种子消毒、药物制造、油脂漂白及鱼池增氧等,还可以作为高温氧化剂。已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成。有人提出CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:通过测量气体的体积判断发生的化学反应,实验装置如下: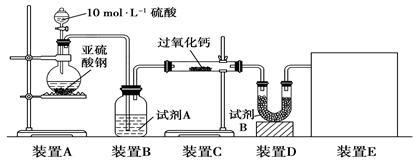
(1)试剂A可以选用________,试剂B的作用是________。
(2)装置E用于测定氧气的体积,请在方框中画出装置图。
(3)实验测得装置C中过氧化钙质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、部分被氧化、完全被氧化的V——m1关系式。
未被氧化:____________,部分被氧化:____________,
完全被氧化:____________。
若SO2完全被氧化,写出反应的化学方程式:___________________________。
实验二:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
提出假设:
假设1:反应后固体只有________,证明SO2未被氧化;
假设2:反应后固体中只有________,证明SO2完全被氧化;
假设3:________________________________________________________。
实验探究:
(4)设计实验,证明假设3是正确的,简要回答实验过程、现象和结论:______
_____________________________________________________________。
实验评价:
(5)实验过程中SO2的通入量直接影响探究实验结果的科学性,请简要说明原因:___________________________________________________________。
为测定某含有杂质Na2O的Na2O2样品的纯度,3个小组分别设计如下方案。首先准确称量样品mg,然后,按照以下方案进行实验,请你完成相关内容:
[方案一]:将样品与水充分反应,使产生的O2通过灼热的铜粉,测得反应后生成氧化铜的质量为ng,通过计算求出试样中Na2O2的含量。Na2O2跟水反应的离子方程式是:;根据所给数据计算出的试样中Na2O2含量的代数式为。
[方案二]:将样品与二氧化碳反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量。
(1)上图是完成该实验可能用到的实验装置,根据此实验方案,实验所使用仪器的连接次序是。(填写仪器编号)
(2)装置①⑤的作用分别是:①⑤。
[方案三]:测定样品与水充分反应后溶液的体积VmL。,再从中取V1mL溶液装入锥形瓶中,用标准浓度的盐酸进行滴定,确定溶液的浓度,再计算出样品中Na2O2的含量。
(1)方案中酸碱滴定时,选用的滴定管为右图中的(填仪器编号)。
(2)若用酚酞做指示剂,达到滴定终点时的现象为。
(3)三个方案相比测定结果最准确的是。
根据以下各物质间的转化关系回答有关问题。

(1)B、C、D的化学式依次为_____________、___________、____________。
(2)A的电子式为_______,它属于___________(填“极性”或“非极性”)分子。
(3)淡黄色粉末与气体A反应的化学方程式为___________________________;黑色固体与稀硫酸反应的离子方程式为_________________________________。
(4)右图为中学化学实验室常用的部分装置或仪器,请填写有关空白。
①淡黄色粉末与气体A的反应,可以选择在上述装置_______
(填字母代号,下同)中进行;气体与粉末B的反应可选用上述装置中的_______作反应发生装置。
②实验室通常用沉淀C和_______________反应制取气体A;制取时的反应装置应选用上述装置中的______________;若要用浓硫酸干燥制得的气体A,应选用上述装置中的__________作干燥装置。
③请写出装置d在中学化学实验中的可能用途(写出两条即可)______________
________________________________________________________________________________________________________________________________________.
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。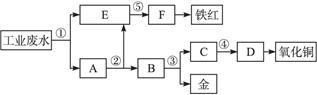
填写下面空白。
(1)图中标号处需加入的相应物质分别是①____________、②___________、③___________、④___________、⑤___________;
(2)写出①处发生反应的离子方程式___________;写出③处发生反应的化学方程式:______________________;
(3)铁红的化学式为___________;分别写出铁红和氧化铜在工业上的一种主要用途:铁红__________________;氧化铜________________________。
现有一份含有FeCl3和FeCl2的固体混合物,为测定各成分的含量进行如下两个实验:
实验1
①称取一定质量的样品,将样品溶解;
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀;
③将沉淀过滤、洗涤、干燥得到白色固体17.22 g。
实验2
①称取与实验1中相同质量的样品,将样品溶解;
②向溶解后的溶液中,通入足量的Cl2;
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀;
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4 g。
根据实验回答下列问题:
(1)溶解过程中所用到的玻璃仪器有_____________________________。
(2)实验室保存FeCl2溶液时通常会向其中加入少量试剂______________和____________。
(3)实验2通入足量Cl2的目的是________________________________;涉及的化学反应的离子方程式是______________________________。
(4)检验实验2的步骤④中沉淀已经洗涤干净的方法是_________________________。
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)。________________________________________________。
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及胶体的特性。以下关于胶体的说法不正确的是________________。
| A.胶体粒子能透过滤纸,但不能透过半透膜 |
| B.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
| C.只有胶体粒子能做布朗运动 |
| D.向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失 |
E.在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算固体样品中FeCl3和FeCl2的物质的量之比为________________。
(8)可以采用下列装置制取少量的FeCl3固体,已知FeCl3易潮解。(部分夹持仪器已略去)
该装置存在不足,往往无法得到FeCl3固体,请你对装置提出合理的改进措施。___________。
有下列实验装置如图:
示意图中A是简易的氢气发生器,B是大小适宜的圆底烧瓶,C是装有干燥剂的U形管,a是旋转活塞,D是装有还原铁粉的反应管,E是装有酚酞的试管。
实验前先检查实验装置的气密性。实验开始时,先关闭活塞a,并取下烧瓶B;向A中加入一定量适当浓度的盐酸,产生氢气。经必要的“操作”〔见问题(2)〕后,在导管的出口处点燃氢气,然后如图所示套上烧瓶B,塞紧瓶塞,氢气在烧瓶中继续燃烧,用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞a,气体通过反应管D进入试管E中,使酚酞试液呈红色。请回答下列问题。
(1)实验前如何检查装置的气密性:</PGN0035B.TXT/PGN>____。
(2)点燃氢气前必须进行____操作,进行该操作的方法是____。
(3)写出B、D中分别发生反应的化学方程式:
B中_______________
D中________________
(4)C中所盛干燥剂的名称是____;该干燥剂的作用是____。