现有一份含有FeCl3和FeCl2的固体混合物,为测定各成分的含量进行如下两个实验:
实验1
①称取一定质量的样品,将样品溶解;
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀;
③将沉淀过滤、洗涤、干燥得到白色固体17.22 g。
实验2
①称取与实验1中相同质量的样品,将样品溶解;
②向溶解后的溶液中,通入足量的Cl2;
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀;
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4 g。
根据实验回答下列问题:
(1)溶解过程中所用到的玻璃仪器有_____________________________。
(2)实验室保存FeCl2溶液时通常会向其中加入少量试剂______________和____________。
(3)实验2通入足量Cl2的目的是________________________________;涉及的化学反应的离子方程式是______________________________。
(4)检验实验2的步骤④中沉淀已经洗涤干净的方法是_________________________。
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)。________________________________________________。
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及胶体的特性。以下关于胶体的说法不正确的是________________。
| A.胶体粒子能透过滤纸,但不能透过半透膜 |
| B.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
| C.只有胶体粒子能做布朗运动 |
| D.向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失 |
E.在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算固体样品中FeCl3和FeCl2的物质的量之比为________________。
(8)可以采用下列装置制取少量的FeCl3固体,已知FeCl3易潮解。(部分夹持仪器已略去)
该装置存在不足,往往无法得到FeCl3固体,请你对装置提出合理的改进措施。___________。
下图为苯和溴的取代反应的改进实验装置图。其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入铁屑粉少量。
填写下列空白:(注:溴苯与NaOH溶液不反应)
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式)_____________。
(2)试管C中苯的作用是________;反应开始后,观察D和E试管,看到的现象为D中_________ ;E中;
(3)反应2 min至3 min后,在B中的NaOH溶液可观察到的现象是。
(4)在上述整套装置中,具有防倒吸的仪器有_______(填字母)
(5)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这3个优点外,还有一个优点是_______________。
酯是重要的有机合成中间体,请回答下列问题:
(1)实验室制取乙酸乙酯的化学方程式为:_____________________。
(2)欲提高乙酸的转化率,可采取的措施有__________________________________、
_____________________________________________等。
(3)若用下图所示的装置来制取少量的乙酸乙酯,产率往往偏低,其原因可能是:___________、
__________________。
(4)实验时可观察到锥形瓶中有气泡产生,用离子方程式表示产生气泡的原因:。
(5)此反应以浓硫酸作为催化剂,可能会造成产生大量酸性废液,催化剂重复使用困难等问题。现代研究表明质子酸离子液体可作此反应的催化剂,实验数据如下表所示(乙酸和乙醇以等物质的量混合):
| 同一反应时间 |
同一反应温度 |
||||
| 反应温度/℃ |
转化率(%) |
选择性(%) |
反应时间/h |
转化率(%) |
选择性(%) |
| 40 |
77.8 |
100 |
2 |
80.2 |
100 |
| 60 |
92.3 |
100 |
3 |
87.7 |
100 |
| 80 |
92.6 |
100 |
4 |
92.3 |
100 |
| 120 |
94.5 |
98.7 |
6 |
93.0 |
100 |
(说明:选择性100%表示反应生成的产物是乙酸乙酯和水)
①根据表中数据,下列________(填编号),为该反应的最佳条件。
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
②当反应温度达到120℃时,反应选择性降低的原因可能是_________________。
过氧化镁MgO2易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等。过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量。某研究小组拟用下图装置测定一定质量的样品中过氧化镁的含量。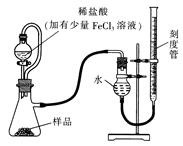
(1)实验前需进行的操作是:,稀盐酸中加入少量FeCl3溶液的作用是:。
(2)用恒压分液漏斗的优点有:①;②。
实验结束时,待恢复至室温,先,再平视刻度线读数。实验室还可通过下列两种方案来测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
(3)推算该样品中过氧化镁的质量分数(用含a、b的表达式表示)。
方案Ⅱ:称取0.1 g样品置于某定量用锥形瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1000 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗28.50 mL Na2S2O3溶液。(已知:I2+2Na2S2O3→Na2S4O6+2NaI)
(4)该实验在滴定前需加入少量作指示剂;判断到达滴定终点的现象是;
(5)推算该样品中过氧化镁的质量分数为。
水中因含有机物而具有较高的化学耗氧量。常用酸性KMnO4氧化有机物测其含量。主要操作步骤如下:
(1)仪器A为(填酸式或碱式)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为。
(2)完善步骤Ⅳ涉及的离子方程式:
C2O42—+MnO4—+=Mn2++CO2↑+
该步骤中KMnO4溶液紫色会逐渐褪去.某探究小组测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图.
请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因:
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00ml,已知滴定后的液面如图所示,请写出滴定前的液面读数。
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl—影响
猜想2:配制Na2C2O4标液定容时。
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl—影响。(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液)。
资料卡片:
1、有机物可被HNO3氧化。
2、AgCl不与酸性KMnO4溶液反应。
3、Ag2C2O4可被酸性KMnO4溶液氧化。
为保护环境,节约资源,某研究性学习小组探究用易拽罐制取明矾[KAl(SO4)2·12H2O]。
查阅资料得知:明矾溶于水,不溶于乙醇:易拉罐主要成分为铝,另含有镁、铁等。
实验步骤如下:
步骤1、将易拉罐剪开,裁成铝片。用砂纸磨去表面的油漆,颜料及透明塑胶内衬:
步骤2、制备NaAlO2
称量1 g上述处理过的铝片,切碎,分数次放入盛有40mL5% NaOH溶液的烧杯中:将烧杯置于热水浴中加热。反应完毕后,溶液呈灰黑色浑浊,趁热过滤。
步骤3、氢氧化铝的生成和洗涤
在所得滤液中滴加3mol·L-1H2SO4溶液,用pH试纸检验,调节pH至8~9为止:此时溶液中生成大量的白色氢氧化铝沉淀,过滤,并用热蒸馏水多次洗涤沉淀
步骤4、明矾的制备
将过滤后所得氢氧化铝沉淀转入蒸发皿中,加10 mL 9mol/L H2SO4,再加15 mL水,小火加热使其溶解,加入4g硫酸钾继续加热至溶解,将所得溶液在空气中自然冷却,待结晶完全后,过滤,用无水酒精洗涤晶体两次;将晶体用滤纸吸干,制得明矾。
回答以下问题:
(1)步骤2中铝片溶于烧碱的反应建议在通风橱中进行,用热水浴加热,避免明火,原因是;过滤后,滤渣的主要成分是。
(2)步骤3中,若调节pH过低,导致的结果是;洗涤氢氧化铝沉淀的方法是。
(3)步骤4中用到的主要仪器是:铁架台(带铁圈),蒸发皿、量筒、漏斗、烧杯、酒精灯和;加入硫酸钾后制取明矾的化学反应方程式是。
(4)不用水而用无水酒精洗涤明矾晶体的原因是。
(5)实验验证明矾晶体中含有SO42—离子的方法是。
(6)该实验制得明矾15.8 g,则称取的1 g铝片中铝元素含量不低于%。