某小组用下图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验)。
实验操作和现象:
| 操作 |
现象 |
| 打开分液漏斗活塞,滴加一定量浓盐酸,加热 |
i.A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii.一段时间后,C中产生大量黄色沉淀。 |
| 用湿润的淀粉碘化钾试纸检验C中白雾 |
淀粉碘化钾试纸变蓝 |
| C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 |
有白色沉淀生成 |
查阅资料:a.S2O32—有较强的还原性
b.酸性条件下S2O32—迅速分解为S和SO2
(1)A中发生反应的离子方程式是 。
(2)B中饱和NaCl溶液的作用是 。
(3)C中生成黄色沉淀的离子方程式是 。
(4)为检验C中是否有SO2生成,需进行的操作是 。
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是 。
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是 。
某实验小组同学用如下实验装置探究铜与浓硫酸的反应。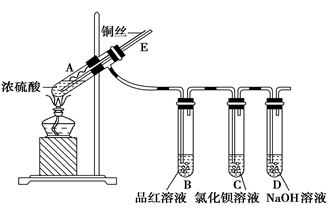
实验步骤:
①先连接好装置,检查气密性,再加入试剂;
②加热A试管,B中品红溶液褪色,熄灭酒精灯;
③将铜丝向上抽动离开液面。
(1)A试管中发生反应的化学方程式为 。
(2)能够证明铜与浓硫酸反应生成气体的现象是 。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其分成两份,分别滴加下列溶液,将产生沉淀的化学式填入下表相应的位置。
| 滴加的溶液 |
氯水 |
氨水 |
| 沉淀的化学式 |
写出其中SO2显示还原性的反应的离子方程式 。
(4)实验完毕后,先熄灭酒精灯,由于导管E的存在,B中的液体不会倒吸入A中,其原因是__________。
(5)实验完毕后,装置中残留气体有毒,不能打开胶塞。为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是 。
某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如下图所示。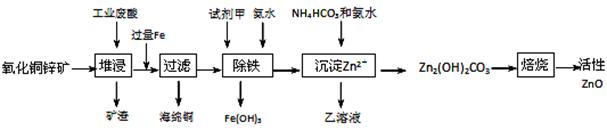
已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
6.34 |
9.7 |
| Fe3+ |
1.48 |
3.2 |
| Zn2+ |
6.2 |
8.0 |
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,这是由于相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的 (填序号)作为试剂甲是比较合适的。
A.KMnO4 B.HNO3 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH)3反应的离子方程式 。
(5)298K时,残留在乙溶液中的c(Fe3+)在 __ mol/L以下。Fe(OH)3的KSP= 2.70×10-39
(6)乙的溶液可直接用作氮肥,则乙的化学式是 。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式 。
MgSO4•7H2O在医药上常用做泻药,工业上可用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。其主要工艺如下: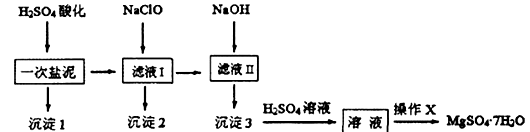
回答下列问题:
(1)用H2SO4调节溶液PH至1~2,H2SO4作用是 。
(2)加NaClO溶液至PH=5~6并加热煮沸5~10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为 、 ;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为 。
(3)检验滤液Ⅱ中是否含有Fe3+的实验方法是 。
(4)“操作X”是将溶液 、 、过滤洗涤,即得到MgSO4•7H2O晶体。
(5)准确称量制得的样品5g,用200mL水溶解,加入2 mol/L的盐酸5mL,在不断搅拌下滴加足量2 mol/LBaCl2溶液,充分反应后,得沉淀4.46g,则样品纯度为 。
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol•L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因: 、 。
(2)甲探究步骤二中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 mol•L-1 FeCl3溶液中滴加2滴0.1 mol•L-1 KSCN溶液,变红,通入O2,无明显变化。
实验I的说明 ;②实验III的目的是 。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 ① mol•L-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH,约为3。由此,乙认为红色不褪去的可能原因是 ② 。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
| 步骤 |
试剂及操作 |
现象 |
| i |
③ |
生成白色沉淀 |
| ii |
向i所得溶液中滴加0.1 mol•L-1 FeCl3溶液 |
④ |
CuSO4溶液与Na2CO3溶液混合产生蓝绿色沉淀,以下是某兴趣小组对沉淀组成的探究。
【提出假设】
假设1:沉淀为Cu (OH)2
假设2:沉淀为
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3·mCu (OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【定性探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如下装置(夹持仪器未画出)进行定性实验;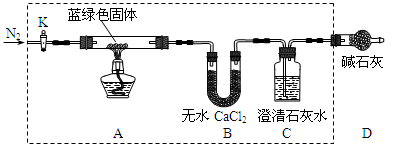
(1)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设 成立。
(2)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是 (填代号)。
A.浓硫酸B.无水CuSO4C.碱石灰D.P2O5
(3)乙同学验证假设3成立的实验现象是 。
【定量探究】
(4)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在20℃的数据(如下表)后,将C中的澄清石灰水改为Ba(OH)2溶液,
其原因是 (填代号)
| 溶解度(S)/g |
溶度积(Ksp) |
摩尔质量(M)/g·mol-1 |
|||
| Ca(OH)2 |
Ba(OH)2 |
CaCO3 |
BaCO3 |
CaCO3 |
BaCO3 |
| 0.16 |
3.89 |
2.9×10-9 |
2.6×10-9 |
100 |
197 |
A.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
B.Ba(OH)2为强碱,Ca(OH)2为弱碱
C.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
D.相同条件下,CaCO3的溶解度明显大于BaCO3
②若所取蓝绿色固体质量为54.2 g,实验结束后装置B的质量增加5.4 g,C中的产生沉淀的质量为39.4 g。则该蓝绿色固体的化学式为 ;A中发生的反应的化学方程式为 。