某实验小组同学用如下实验装置探究铜与浓硫酸的反应。
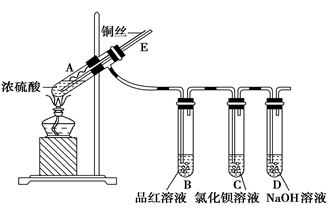
实验步骤:
①先连接好装置,检查气密性,再加入试剂;
②加热A试管,B中品红溶液褪色,熄灭酒精灯;
③将铜丝向上抽动离开液面。
(1)A试管中发生反应的化学方程式为 。
(2)能够证明铜与浓硫酸反应生成气体的现象是 。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其分成两份,分别滴加下列溶液,将产生沉淀的化学式填入下表相应的位置。
| 滴加的溶液 |
氯水 |
氨水 |
| 沉淀的化学式 |
|
|
写出其中SO2显示还原性的反应的离子方程式 。
(4)实验完毕后,先熄灭酒精灯,由于导管E的存在,B中的液体不会倒吸入A中,其原因是__________。
(5)实验完毕后,装置中残留气体有毒,不能打开胶塞。为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是 。
测量一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800mL烧杯、100mL量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19g·cm-3)、水。按图2-1-2装置进行实验,回答下列问题(设合金样品全部反应,产生的气体不超过100mL)。
(1)补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在800mL烧杯底部,把短颈漏斗倒扣在样品上面。
(2)合金样品用铜网包裹的目的是:
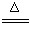
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为 
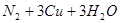
试回答:
(1)如果选用测定反应物CuO和生成物H2O的质量(m(CuO)、m(H2O))时,请用下列仪器设计一个简单的试验方案。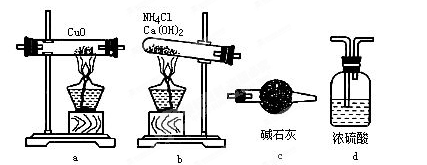
① 仪器连接的顺序(用字母编号表示,仪器可重复使用)_________;
d中浓硫酸的作用是________,______;
实验完毕时观察到a中的现象是__________;
② 列出计算Cu的相对原子质量的表达式_________;
③ 下列情况将使测定结果偏大的是________。(以下选择填空不限1个正确答案,均用字母编号填写)
A. CuO未全部还原为Cu
B. CuO受潮
C. CuO中混有Cu
(2)如果仍采用上述仪器装置,其它方案可选用测定的物理量有_______
A. m(Cu)和m(CuO) B. m(N2)和m(H2O)
C. m(Cu)m(H2O) D. m(NH3)和m(H2O)
某学生设计了三个实验方案,用以检验淀粉的水解情况。
⑴方案甲:淀粉液 水解液
水解液 中和液
中和液 溶液变蓝
溶液变蓝
结论:淀粉没有水解
⑵方案乙:淀粉液 水解液
水解液 无红色沉淀
无红色沉淀
结论:淀粉没有水解
⑶方案甲:淀粉液 水解液
水解液 中和液
中和液 有红色沉淀
有红色沉淀
结论:淀粉已水解
以上三种方案的设计及结论是否正确?如不正确,请简述理由。
实验室里用一般的气体发生装置来制备Cl2,反应物即使在停止加热后反应还会继续一段时间,当要收集多瓶Cl2时,常有较多的Cl2逸散到空气中去,为了避免Cl2的逸散,并对多余的Cl2随时取用,有人设计了如下图的甲装置来制取Cl2: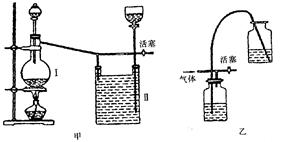
(1)设计甲装置是依据了(填已学某仪器名称)的原理。甲中装置
Ⅱ(填能或不能)用乙装置来代替。
(2)甲中Ⅱ中盛有的液体是,该装置可看作是一个(填某仪器名称),简述其主要原理:
实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:
(1)写出烧瓶中发生反应的化学方程式,并标出电子转移的方向和数目。
(2)B处盛有饱和食盐水(或水),其作用是。
(3)C处盛放的试剂__________(填名称),其作用是。 (4)E处盛有___________(填名称),发生反应的离子方程式为_________。
(4)E处盛有___________(填名称),发生反应的离子方程式为_________。
(5)实验结束时,应先熄灭__________处酒精灯。