在容积恒定的密闭容器中,一定量的SO2与1.1 mol O2发生反应:2SO2(g) + O2(g) 2SO3(g) ΔH<0。当气体的物质的量减少0.315 mol时,反应达到平衡,SO2的平衡转化率是90%。下列说法正确的是
2SO3(g) ΔH<0。当气体的物质的量减少0.315 mol时,反应达到平衡,SO2的平衡转化率是90%。下列说法正确的是
| A.相同条件下,平衡时若充入稀有气体,SO2的转化率增大 |
| B.反应开始时,向容器中通入的SO2的物质的量是0.7 mol |
| C.保持其他条件不变,仅降低温度,正反应速率减小程度比逆反应速率减小程度大 |
| D.保持其他条件不变,仅缩小容器体积,达到平衡时容器中有1.485 mol气体 |
将 0.2mol MnO2和50mL 12mol/L 盐酸混合后缓缓加热,反应完全后留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀的物质的量为(不考虑盐酸的挥发)( )
| A.0.3mol | B.小于0.3mol | C.大于0.3mol,小于0.6mol | D.以上都不正确 |
将一定量的镁铝合金样品分成两等份,一份加入足量NaOH溶液中,充分反应后,收集到标准状况下气体6.72L;另一份加入到足量稀盐酸中,充分反应后,收集到标准状况下气体11.2L。则原合金样品中镁的质量为 ( )
| A.4.8 g | B.6 g | C.9.6 g | D.12 g |
已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是 ( )
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是 ( )
| A.加少量烧碱 | B.降低温度 | C.加少量冰醋酸 | D.加水 |
下列各组物质中化学键的类型相同的
A.HCI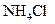 |
B.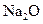 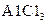 |
C.NaOH 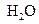 |
D.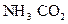 |
某课外活动小组使用下列用品设计原电池。用品:铜片、铁片、导线、金属夹、发光二极管、果汁(橙汁、苹果汁)500mL,、烧杯。下列说法正确的是
A.该装置能将电能转化为化学能 B.实验过程中铜片逐渐溶解
C电子由铁片通过导线流向铜片 D.铁片上会析出红色的铜