(14分)氧化锌是橡胶、油漆、搪瓷、电缆、医药、电子、化学等工业的重要原料。以氧
化锌粗品为原料制备活性氧化锌的生产工艺流程如下:
(1).浸出”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+、 +、Mn2+等
+、Mn2+等
杂质。物质A的作用是调节溶液的pH至5 4,物质A最好选择________。
| A.NH3.H2O | B.Na2CO3 | C.H2SO4 | D.ZnO |
已知25℃时部分金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH如下表: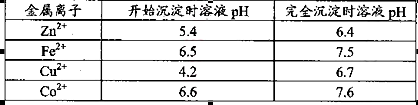
该温度下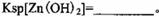 。
。
(2) KMnO4的作用是除去Mn2+和Fe2+,则KMnO4与Mn2+反应的离子方程式为_____________________________________;若溶液中 ,则处理1
,则处理1 该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
(3)杂质Cu2+、 2+可利用置换反应除去,则物质B是_________。
2+可利用置换反应除去,则物质B是_________。
(4)被灼烧的沉淀是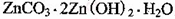 ,生成该沉淀的化学方程式为________。
,生成该沉淀的化学方程式为________。
如何检验该沉淀是否洗净?________________________________。
选做(10分)由乙烯和其他无机原料合成环状化合物其合成过程如下(水及其他无机产物均已省略):
请分析后回答下列问题:
(1)反应的类型分别是①_____________ ②________________
(2)D物质中的官能团为___________________________
(3)C物质的结构简式_____________,物质X与A互为同分异物体,则X的结构简式为_________,X的名称为_______________________________
(4)A→B的化学方程式(注明反应条件)____________________________
莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一。莽草酸 (A)的结构简式为: (提示:环丁烷
(提示:环丁烷 可简写成□)
可简写成□)
(1)A的分子式为___________
(2)A与溴的四氯化碳溶液反应的化学方程式为___________
(3)A与氢氧化钠溶液反应的化学方程式为___________
(4)17.4 g A与足量的碳酸氢钠溶液反应,则生成的二氧化碳的体积(标准状况)为________________
(5)A在浓硫酸作用下加热可得到B(B的结构简式为 ),其反应类型是___________
),其反应类型是___________
1mol分子组成为C3H8O的液态有机物A,与足量的金属钠作用,可生成11.2 L氢气(标准状况),则A分子中必有一个___基,若此基在碳链的一端,则A的结构简式为。A与浓硫酸共热,分子内脱去1分子水,生成B,反应的方程式为;B通入溴水能发生________反应,反应的方程式为。
(10分)0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol。试回答:
(1)烃A的分子式为________________
(2)若取一定量的该烃A完全燃烧后,生成CO2和H2O各3mol,则有______g烃A参加了反应。
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为______
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为______(任写1个)
(5)比烃A少一个碳原子且能使溴水褪色的A的同系物有______种同分异构体.
写出下列反应的化学方程式。
(1)苯与液溴发生取代反应________________
(2)制乙酸乙酯的反应________________
(3)在苯酚钠溶液中通入过量的二氧化碳气体________________
(4)苯酚溶液与溴水的反应___________________________