下列叙述不正确的是
| A.在稀盐酸中 c(H+)=c(Cl—)+c(OH—) |
B.常温下,在0.1mol/L的HNO3溶液中由水电离出的c(H+)<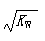 |
| C.将Na2CO3水溶液加热、蒸干,最后得到NaOH固体 |
| D.酸与碱完全中和,所得溶液的pH可能大于7 |
下列化合物的分子中,所有原子都处于同一平面的有( )
| A.乙烷 | B.甲苯 |
| C.乙醛 | D.四氯乙烯 |
下列离子方程式的书写正确的是
| A.NaHCO3溶液与NaOH溶液反应: OH- + HCO3- = CO32- + H2O |
| B.铁和稀硫酸反应: 2Fe + 6H+ = 3H2↑+ 2Fe3+ |
| C.向AlCl3溶液中加入过量的NaOH溶液: Al3+ + 3OH-= Al(OH)3↓ |
| D.实验室用大理石和稀盐酸制取CO2: 2H+ + CO32- = CO2↑+ H2O |
证明某溶液含有Fe2+而不含有Fe3+的实验方法是
| A.先滴加氯水,再滴加KSCN溶液后显红色 |
| B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色 |
| C.滴加NaOH溶液,看是否出现红褐色沉淀 |
| D.只需滴加KSCN溶液 |
下列溶液中Cl-离子浓度最大的是
| A.65mL 1mol/L的KCl溶液 |
| B.25mL 3mol/L的NaCl溶液 |
| C.20mL 2mol/L的MgCl2溶液 |
| D.10mL 1.5mol/L的AlCl3溶液 |
下列反应不属于四种基本反应类型,但属于氧化还原反应的是
| A.3CO + Fe2O3 ="===" 2Fe + 3CO2 |
| B.AgNO3 + NaCl =" AgCl" + NaNO3 |
| C.Cl2 + 2NaBr =" 2NaCl" + Br2 |
| D.2Cu + O2 ==2CuO |