在2 L的密闭容器中发生反应xA(g)+yB(g) zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是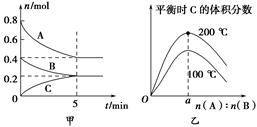
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g) zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
随着社会的发展,人们日益重视环境问题,下列说法不正确的是
| A.绿色化学的核心是利用化学原理从源头上减少和消除化学工业生产对环境的污染 |
| B.对废旧电池进行回收处理主要是为了防止重金属污染水源和土壤 |
| C.“煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霆天气 |
| D.PM2.5是指大气中直径接近于2.5×10-6m的细颗粒物,它们分散在空气中形成的混合物具有丁达尔效应 |
在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+3B2(g) 2AB3(g) ΔH<0,相关数据如下表所示:
2AB3(g) ΔH<0,相关数据如下表所示:
| 容器 |
甲 |
乙 |
丙 |
| 相关条件 |
恒温恒容 |
绝热恒容 |
恒温恒压 |
| 反应物投料 |
1mol A2、3mol B2 |
2mol AB3 |
2mol AB3 |
| 平衡时容器体积 |
V甲 |
V乙 |
V丙 |
| 反应的平衡常数K= |
K甲 |
K乙 |
K丙 |
| 平衡时AB3的浓度/mol·L-1 |
c甲 |
c乙 |
c丙 |
| 平衡时AB3的反应速率/mol·L-1·min-1 |
v甲 |
v乙 |
v丙 |
下列说法正确的是
A.V甲>V丙B.K乙<K丙
C.c乙>c甲D.v甲=v丙
下列溶液中粒子的物质的量浓度关系正确的是
| A.25 ℃时,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
| B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C.NH4C1溶液中离子浓度大小关系为c(Cl-)>c(H+)>(NH4+)>c(OH-) |
| D.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中c(K+)=c(H2X)+c(HX-)+c(X2-) |
设NA为阿伏伽德罗常数的值。下列说法正确的是
| A.30g乙酸和甲醛的混合物中氧原子数为NA |
| B.由2H和18O组成的水11 g,所含的中子数为5NA |
| C.室温下,pH=13的NaOH溶液中含有的OH-个数为0.1NA |
D.反应3H2(g)+N2(g)  2NH3(g) ΔH=-92 kJ/mol放出热量9.2 kJ时,转移电子小于0.6 NA 2NH3(g) ΔH=-92 kJ/mol放出热量9.2 kJ时,转移电子小于0.6 NA |
下列根据实验操作及现象所得出的结论中,正确的是
| 选项 |
实验目的 |
实验方案 |
| A |
检验亚硫酸钠试样是否变质 |
取适量试样溶于水,滴加硝酸钡溶液产生白色沉淀,再滴加稀盐酸,沉淀不溶解,说明试样已变质 |
| B |
证明Na2CO3溶液中存在水解平衡 |
在滴有酚酞的Na2CO3溶液中,加入BaC12溶液后红色褪去。 |
| C |
验证Ksp(AgCl)>Ksp(AgI) |
向5 mL 0.1 mol/L AgNO3溶液中滴加3滴0.1 mol/LNaCl溶液,产生白色沉淀;再向其中滴加3滴0.1mol/L的KI溶液,有黄色沉淀产生 |
| D |
溴和苯发生加成反应 |
将苯滴入溴水中,振荡,静置,溴水层褪色 |