【化学——选修2:化学与技术】
下列问题涉及煤在化工生产中的应用:
(1)煤的转化技术包括煤的气化技术和液化技术。
煤的液化技术又分为 和
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为 ;第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 、 等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:____________________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:__________________________
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过 杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是___________________________________。
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。
一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下: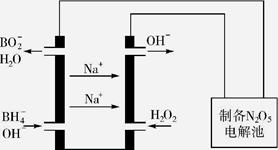
4NO2(g)+O2(g) 2N2O5(g)
2N2O5(g)
(1)已知平衡常数K350℃<K300℃,则该反应是_________反应(填“吸热”或“放热”);常温下,该反应能逆向自发进行,原因是_______________________________________。
(2)下列有关该反应的说法正确的是___________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等。
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是__________。
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍 ,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱。按照这个理论,下列微粒属于两性物质的是___________。
a.H2O
b.NO2-
c.H2NCH2COOH
d.H2PO4-
e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是___________________________________________(用离子方程式表示)。
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01 mol·L-1的X、Y、Z、W溶液的pH。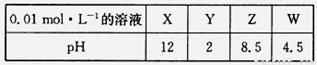
将X、Y、Z各1mol·L-1同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为 ________________________________________________。
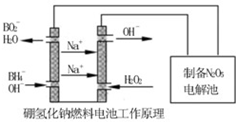
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为。
X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,X的单质只有氧化性.
(1)写出实验室制取W2反应的离子方程式.
(2)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究YX2和W2的性质.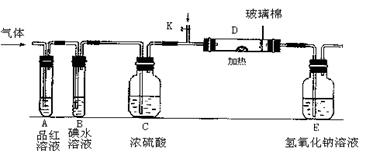
①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”);若装置D中装的是铁粉,当通入W2时D中观察到的现象为;若装置D中装的是五氧化二钒,当通入YX2时,打开K通入适量X2,化学反应方程式为;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为.
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母),可以看到白色沉淀生成,其原因为 ______________________(写出其中一种即可).
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 |
(4)若由元素Y和X组成—2价酸根Z,Z中Y和X的质量比为Y:X=4:3,当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生.写出W2与Z的溶液完全反应产生浅黄色沉淀的离子方程式.
(1)在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)
 2C(g) ΔH < 0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是(填序号字母)
2C(g) ΔH < 0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是(填序号字母)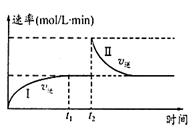
a.0~t1时,v正>v逆 ,t2时,v逆>v正
b.混合气体的密度不再改变时,Ⅰ、Ⅱ两过程达到平衡
c.t2时刻改变的条件可以是向密闭容器中加C
d.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ
(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2]。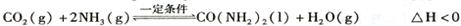
t℃时,向容积恒定为2L的密闭容器中加入0.10 molCO2和0. 40 molNH3,70 min开始达到平衡。反应中CO2 ( g)的物质的量随时间变化如下表所示:
| 时间/min |
0 |
20 |
70 |
80 |
100 |
| n(CO2) /mol |
0.10 |
0.060 |
0.020 |
0.020 |
0.020 |
①20 min时,平均反应速率υ (CO2 )=mol/L·min。
②在100 min时,保持其它条件不变,再向容器中充入0. 050 mo1CO2和0. 20 molNH3,重新建立平衡后CO2的转化率与原平衡相比将(填“增大”、“不变”或“减小”)。
③上述可逆反应的平衡常数为_(保留一位小数)。
④下图所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气。该装置中阳极的电极反应式为,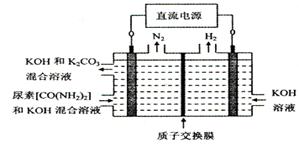
(3)CH4燃料电池,装置示意如图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。当 V="44.8" L时,电池总反应方程式为;用该电池为电源,以石墨作电极,电解上述实验分离出的溶液,两极均产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是________________。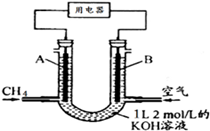
I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是(填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而改变 |
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为;
(3)计算该反应的平衡常数K=。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1w2 (填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示: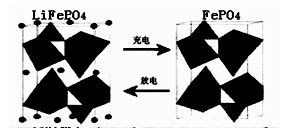
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的极(填“正”或“负”),该电极反应式为。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L。
(17分)运用化学反应原理研究碳、氮、硫元素及其化合物有重要意义。
(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图所示: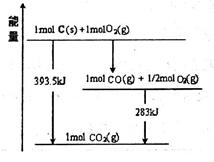
写出CO2(g)与C(s)反应生成CO(g)的热化学方程式_______________________。
(2)汽车尾气净化过程中发生反应2NO(g)+2CO(g) N2+2CO2(g)△H<0。一定条件下,向某密闭恒容容器中按体积比1:l充入44.8L(标准状况)NO和CO混合气体,发生上述反应,某同学根据反应过程中的有关数据绘制了如图所示曲线。
N2+2CO2(g)△H<0。一定条件下,向某密闭恒容容器中按体积比1:l充入44.8L(标准状况)NO和CO混合气体,发生上述反应,某同学根据反应过程中的有关数据绘制了如图所示曲线。
①下列关于上述反应过程的叙述正确的是 ________(填写字母代号)。
| A.其它条件不变,加入催化剂,△H的值不变 |
| B.及时除去二氧化碳,反应的正反应速率加快 |
| C.NO、CO、N2、CO2浓度均不再变化,说明平衡未发生移动 |
| D.混合气体的平均相对分子质量不再改变,证明反应达到化学平衡状态 |
②前10min内CO的平均反应速率为______,达平衡时NO的转化率为_____,能使上述平衡体系中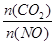 增大的措施有__________(任写一条)。
增大的措施有__________(任写一条)。
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表(单位省略):
| 弱电解质 |
H2CO3 |
H2SO3 |
NH3·H2O |
| 电离平衡常数 |
Ka1=4.2×10-7 Ka2=5.6×10-11 |
Ka1=1.54×10-2 Ka2=1.02×10-7 |
Kb=1.7×10-5 |
①室温条件下。用敞口容器加热氨水一段时间,恢复至室温后,溶液中水的电离程度比加热前_______(填写“增大”、“减小”或“不变”)了.
②常温下,0.1 mo1·L-1(NH4)2SO4溶液呈_____(填“酸”、“中”、“碱”)性。
③常温下,测得某碳酸饮料的pH=6,则该饮料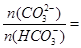 ________。
________。