(本题共12分)
沸石是一大类天然结晶硅铝酸盐的统称。自然界中已发现的沸石有30多种,较常见的有方沸石NaAlSi2O6·H2O、钠沸石Na2Al2Si3O10·2H2O和钙沸石CaAl2Si3O10·3H2O等。
完成下列填空:
23.钠原子核外共有 种不同能量的电子,这些电子分占 种不同的轨道。
24.常温下,下列5种钠盐浓度均为0.1mol·L-1的溶液,对应的pH如下:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
上述盐溶液中的阴离子,结合H+能力由强到弱的顺序是____________________________。
25.NaOH在实验室中常用来进行洗气和提纯,当300mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__________________________。
26.金属铝与一般的金属比较,在化学性质上表现出的三大特性为:
。
27.晶体硅、金刚石和金刚砂(SiC)硬度由大到小的顺序是 。
28.钙沸石CaAl2Si3O10·3H2O改写成氧化物的形式为 。
【有机化学基础】
用甲苯生产一种常用的化妆品防霉剂,其生产过程如图(反应条件没有全部注明).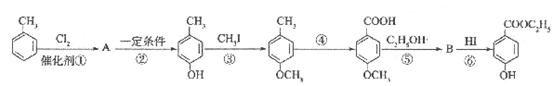
根据转化图填空
(1)有机物A的结构简式_____________
(2)在合成路线中,设计第③步反应的目的是:__________________________.
(3)写出反应⑤的化学方程式__________________________________________.
(4)请写出由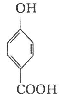 生成C7H5O3Na的化学反应方程式______________________________.
生成C7H5O3Na的化学反应方程式______________________________.
(5)下列有关说法正确的是_____________。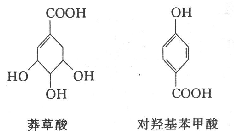
A.莽草酸、对羟基苯甲酸都属于芳香族化合物
b.1 mol莽草酸与NaOH溶液反应,最多消耗4 molNaOH
c.二者均可以发生酯化、氧化、加成等反应
d.利用FeCl3溶液可区别莽草酸和对羟基苯甲酸
(6)写出同时符合下列要求的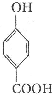 所有同分异构体的结构简式_____________.
所有同分异构体的结构简式_____________.
A.含苯环
b.可与FeCl3溶液发生显色反应
c.一氯代物有两种
d.能发生银镜反应,不能发生水解反应。
(15分)氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下: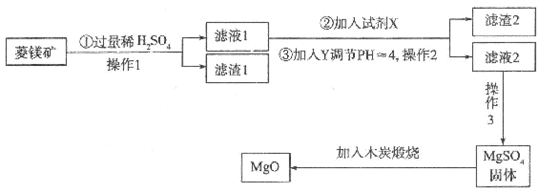
(1)试剂X为_________(填化学式),发生反应的离子反应方程式为_________。
(2)滤渣2的成分是_________(填化学式)。
(3)操作3包括_________、冷却结晶、_________、洗涤、干燥等一系列操作,在此过程中玻璃棒的作用是_________(填代号)
①引流②搅拌加速溶解③搅拌使溶液受热均匀,防止暴沸
(4)煅烧过程存在以下反应:2MgSO4+C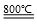 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C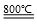 MgO+SO2↑+CO↑ MgSO4+3C
MgO+SO2↑+CO↑ MgSO4+3C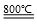 MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。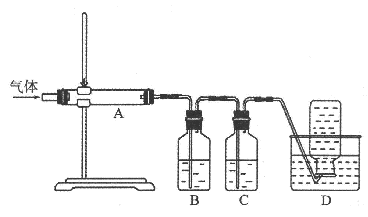
①D中收集的气体是_________(填化学式)。
②B中盛放的溶液可以是_________(填字母)。
A.NaOH溶液b.Na2CO3溶液 c.KMnO4溶液 d.稀硝酸
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:_________。
运用化学反应原理分析解答以下问题
(1)250℃时,以镍合金为催化剂,向4L容器中通人6 mol CO2、6 molCH4,发生如下反应:CO2(g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 |
CH4 |
CO2 |
CO |
H2 |
| 体积分数 |
0.1 |
0.1 |
0.4 |
0.4 |
①此温度下该反应的平衡常数K=___________.
②若再向容器中同时充入2.0molCO2、6.0 molCH4、4.0 molCO和8.0 molH2,则上述平衡向_____(填“正反应”或“逆反应”)方向移动。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
已知:① NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH= —41.8KJ·mol-1
SO3(g)+NO(g) ΔH= —41.8KJ·mol-1
②2SO2(g)+O2(g)  2SO3(g) ΔH= —196.6KJ·mol-1
2SO3(g) ΔH= —196.6KJ·mol-1
①写出NO和O2反应生成NO2的热化学方程式__________。
②一定温度下,向2L恒容密闭容器中充人NO2和SO2各1 mol,5min达到平衡,此时容器中NO和NO2的浓度之比为3:1,则NO2的平衡转化率是_________。
(3)常温下有浓度均为0.1 mol/L的四种溶液:①Na2CO3、②NaHCO3、③HCl、④NH3.H2O。
①有人称溶液①是油污的“清道夫”,原因是_________(用离子方程式解释)
②上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为__________。
③向④中加入少量氯化铵固体,此时c(NH4+)/ c(OH-)的值_________(填“增大”“减小”或“不变”)。 ④若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积_________④的体积(填“大于”小于”或“等于”)
⑤将10 mL溶液③加水稀释至100 mL,则此时溶液中由水电离出的c( H+)=___________。
铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题。
(1)工业上可用Cu2S+O2 2Cu+SO2。反应制取粗铜,当消耗32 g Cu2S时,转移电子的物质的量为____________________。
2Cu+SO2。反应制取粗铜,当消耗32 g Cu2S时,转移电子的物质的量为____________________。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃-60℃,加入H2O2,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:________________.CuSO4溶液中加入一定量的Na2SO3溶液和NaCI溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式________________________。
(3)电子工业常用30%的FeCl3溶液腐蚀附在绝缘板上的铜箔制造印刷电路板,取其腐蚀后的废液,加入一定量的铁粉后,若无固体剩余,则反应后的溶液中肯定有的离子是________________;若有红色固体,则反应后的溶液中肯定没有的离子是________,检验该离子的试剂为________。
(4)铁氰化钾 K3[Fe(CN)5]和亚铁氰化钾K4[Fe(CN)6] 的混合溶液可用于太阳能电池的电解液,该太阳能电池的工作原理示意图如图所示,其中催化剂a为________极,电极反应式为________;
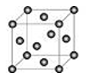
前四周期元素A、B、C、D、E原子序数依次增大,A是周期表所有原子中原子半径最小的,B有三个能级,且各个能级上电子数相等,D与C同周期,且C中未成对电子是该周期中最多的;D基态原子的2p电子是2s电子的2倍;E有4个电子层,且与A最外层电子数相同,其他各层均排满。
(1)写出E2+的基态核外电子排布式。
(2)A和C可以形成18电子的分子,该分子中C原子的杂化方式为。
(3)C与D形成的酸根离子CD3-
①CD3-的空间构型为(用文字描述)。
②写出一种与CD3-互为等电子体的分子的化学式。
(4)CA3的沸点比BA4的沸点高的原因是。
(5)E2+与C的常见氢化物形成配位数为4的配合物离子,1mol该离子中含σ键数目为。
(6)E晶胞结构如图所示,该晶体中每个E原子周围距离最近的E原子数目为。