【化学—物质结构与性质】
氮、磷属于同主族元素,广泛存在于生产生活的各种物质中。
(1)N原子价电子轨道表示式 ;
(2)PCl5晶体中只有PCl4+和PCl6-微粒,其晶体结构与氯化铯相同。PCl5晶体类型是 ;PCl4+的空间构型是 ;
(3)PCl6-呈正八面体的结构(如图),该离子中 (填“是”或“否”)存在配位键,原因是 ;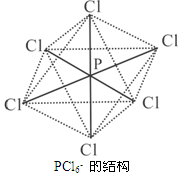
(4)NCl3分子中,N原子杂化方式是 ;NCl3不稳定,易发生分解:2NCl3(l)=N2(g)+3Cl2(g),分解过程中形成σ键和π键数目之比为 ;
(5)C、N、O三种元素的第五电离能(I5)由大到小顺序是 。
下列分子中,所有原子都处在同一平面的是:
| A.2-溴丙烷 | B.氯乙烯 | C.丙炔 | D.甲苯 |
某化合物的结构(键线式)及球棍模型如下:
 |
 |
该有机分子的核磁共振氢谱图如下(单位ppm)。

 下列关于该有机物的叙述正确的是:
下列关于该有机物的叙述正确的是:
| A.该有机物不同化学环境的氢原子有4种 |
| B.该有机物属于芳香族化合物 |
| C.键线式中的Et代表的基团为-CH3 |
| D.该有机物在一定条件下能够发生取代反应 |
以葡萄糖(C6H12O6)为燃料的微生物燃料电池结构如图所示。认真观察分析图示信息,判断下列叙述正确的是
| A.该电池能够在高温下工作 |
| B.电池的正极反应为:O2 + 4e- + 4H+= 2H2O |
| C.放电过程中,H+从正极区向负极区迁移 |
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体 |
在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)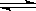 xC(g)+2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
xC(g)+2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
| A.x=1 |
| B.2min内A的反应速率为0.3 mol·(L·min)-1tesoon |
| C.该反应达到平衡状态时A的物质的量与总物质的量之比为2:5 |
| D.若混合气体的压强不变,则表明该反应已达到平衡状态 |
可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法正确的是
| A.电池工作时,电子通过外电路从正极流向负极 |
| B.以NaOH溶液为电解质溶液时,负极反应为:Al+3OH--3e-=Al(OH)3↓ |
| C.以NaOH溶液为电解质溶液时,电池在工作过程中电解液的pH保持不变 |
| D.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH- |