下列说法中正确的是
| A.NO2溶于水得到HNO3,所以NO2属于酸性氧化物 |
B.过氧化钠与水反应的离子方程式为: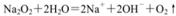 |
| C.漂白粉和水玻璃长期暴露在空气中失效,其原理完全相同 |
| D.足量Zn与一定量浓硫酸充分反应得到混合气体 |
有体积相同、pH相等的烧碱溶液和氨水,下列叙述中正确的是
| A.两溶液中OH-离子浓度相同 | B.用同浓度的盐酸中和时,消耗盐酸的体积相同 |
| C.两溶液溶质物质的量浓度相同 | D.加入等体积的水稀释后,它们的pH仍相等 |
下列说法正确的是
| A.铜、石墨均导电,所以它们均是电解质 |
| B.NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质 |
| C.液态HCl、固体NaCl均不导电,所以HCl、NaCl均是非电解质 |
| D.蔗糖、酒精在水溶液或熔融状态下均不导电,所以它们均是非电解质 |
对于可逆反应:m A(g) + n B(g) x C(g),在不同温度及压强(p1, p2)条件下,反应物A的转化率如图所示,下列判断正确的是
x C(g),在不同温度及压强(p1, p2)条件下,反应物A的转化率如图所示,下列判断正确的是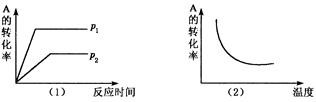
| A.△H > 0, m + n > x | B.△H > 0, m + n < x |
| C.△H < 0, m + n < x | D.△H < 0, m + n > x |
下列有关热化学方程式的叙述中,正确的是( )
A.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热化学方程式为 NaOH(aq)+HCl(aq) 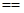 NaCl(aq)+H2O(l) ΔH=+57.4 kJ/mol NaCl(aq)+H2O(l) ΔH=+57.4 kJ/mol |
B.已知C(石墨,s) 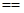 C(金刚石,s) ΔH>0,则金刚石比石墨稳定 C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
C.已知2H2(g)+O2(g) 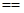 2H2O(g) ΔH=-483.6 kJ/mol,则H2燃烧热为241.8 kJ/mol 2H2O(g) ΔH=-483.6 kJ/mol,则H2燃烧热为241.8 kJ/mol |
D.已知2C(s)+2O2(g) 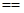 2CO2(g) ΔH1,;2C(s)+O2(g) 2CO2(g) ΔH1,;2C(s)+O2(g) 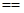 2CO(g) ΔH2;则ΔH1<ΔH2 2CO(g) ΔH2;则ΔH1<ΔH2 |
对于反应:2X+Y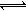 2Z(正反应为放热反应),若升高温度则能使( )
2Z(正反应为放热反应),若升高温度则能使( )
| A.反应速率不变,Z的产量减少 | B.反应速率增大,Z的产量增大 |
| C.反应速率增大,Y的转化率降低 | D.反应速率减小,Z的产量增大 |