现有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。已知A与E、D与G分别同主族;E、F、G、H同周期;A分别与C、D可形成含有10个电子的共价化合物M、N;B的最外层电子数是其电子层数的2倍;D是地壳中含量最多的元素;F位于B的前一主族。请回答下列问题:
(1)元素B在周期表中的位置 ,M的空间构型是 。
(2)A、D、E三种元素组成一种常见化合物,W与该化合物的阴离子具有相同的原子种类和数目且不带电,W的电子式为 ,工业上利用某一个反应可同时生产该化合物和H的单质,写出该反应的化学方程式 。
(3)E、F元素的最高价氧化物对应的水化物之间反应的离子方程式 。
(4)M、N均能结合H+,其中结合H+能力较强的是 (填化学式),用离子方程式证明 。
(5)E分别与D、G形成摩尔质量相等的化合物X、Y,其中Y的水溶液显碱性的原因是 (用离子方程式表示)。常温下7.8 g X与水反应放出Q kJ热量(Q>0),写出该反应的热化学方程式 。
某无色透明溶液跟金属铝反应放出H2。试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、SO32-、HCO3-、OH-、NO3-,在下列两种情况下何者能存在于溶液中。
(1)当生成Al3+时,可能大量存在。
(2)当生成[Al (OH)4]-时,可能存在。
溶氧分析仪能连续、自动测量水中微量的溶解氧含量,可用于工业锅炉用水,实验室制备除氧水等方面。溶氧分析仪的核心部件是氧传感器,传感器中银做阳极,金做阴极,二电极之间连接一稳定的直流电源,以氯化钾溶液为电解质溶液,电解质溶液与取样水之间有一层氧气可以透过的薄膜,测量金电极上产生的还原电流的大小得出氧气的含量。
⑴ 试写出溶氧分析仪的有关电极反应式
阴极_______________________________,阳极____________________________________
⑵ 请从你写的电极反应式推测影响氧传感器的性能的因素可能有哪些?
在高温下高炉中氧含量的测定可用氧化锆(ZrO2)氧传感器来测定,在氧化锆中加入MgO,Y2O3等立方晶系的氧化物后,在600℃以上高温时成为氧的快离子导体。其导电性能主要源于掺杂晶体中的氧离子空位。下图为氧化锆固体电解质的导电原理。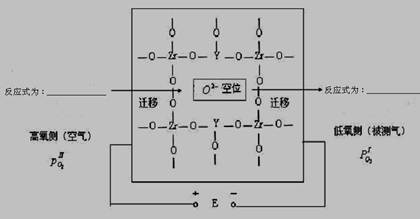
⑶ 写出高氧侧和低氧侧的电极反应式
高氧侧______________________________,低氧侧________________________________
⑷ 若某掺杂电极Y2O3的ZrO2晶体中氧离子空位数为3.01×1020个,则理论上掺杂的Y2O3质量为多少克?
工业制CuSO4时,不是直接用铜跟浓硫酸在加热条件下反应,而是将铜丝浸入稀硫酸中,再不断由容器下部吹入细小的空气泡。这样做的好处是。
在二氧化碳中混有少量的二氧化硫、三氧化硫、氯化氢杂质。设计一种一步只除去一种杂质,最后得到干燥纯净二氧化碳的实验方案。试回答:
(1)使气体经过各试剂(自选)的顺序为______________;
(2)写出有关的离子方程式:______________。
A、B、C为3种单质(其中A为固体,B、C为气体),D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。它们之间的转化关系如右图:
请填写下列空白:
(1)物质A是,B是,C是。
(2)F中加入NaOH溶液,并在空气中放置的化学方程式是,。